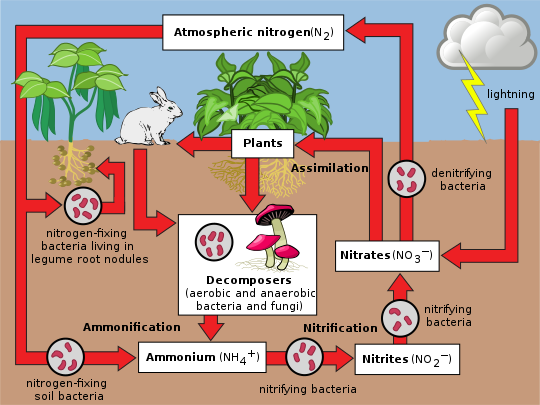
Κύκλος του αζώτου

Ο κύκλος του αζώτου είναι ο βιογεωχημικός κύκλος με τον οποίο το άζωτο μετατρέπεται σε πολλαπλές χημικές μορφές καθώς κυκλοφορεί μεταξύ ατμόσφαιρας, χερσαίων και θαλάσσιων οικοσυστημάτων. Η μετατροπή του αζώτου μπορεί να πραγματοποιηθεί τόσο μέσω βιολογικών όσο και φυσικών διεργασιών. Σημαντικές διεργασίες στον κύκλο του αζώτου περιλαμβάνουν τη δέσμευση του αζώτου (nitrogen fixation), την αμμωνιοποίηση (ammonification), τη νιτροποίηση (nitrification) και την απονιτροποίηση (denitrification). Η πλειονότητα της ατμόσφαιρας της Γης (78%) είναι ατμοσφαιρικό άζωτο,[16] καθιστώντας το τη μεγαλύτερη πηγή αζώτου. Ωστόσο, το ατμοσφαιρικό άζωτο έχει περιορισμένη διαθεσιμότητα για βιολογική χρήση, οδηγώντας σε έλλειψη (scarcity) χρησιμοποιήσιμου αζώτου σε πολλούς τύπους οικοσυστημάτων. Ο κύκλος του αζώτου έχει ιδιαίτερο ενδιαφέρον για τους οικολόγους επειδή η διαθεσιμότητα αζώτου μπορεί να επηρεάσει τον ρυθμό των βασικών διεργασιών του οικοσυστήματος, συμπεριλαμβανομένης της πρωτογενούς παραγωγής και της αποσύνθεσης. Οι ανθρώπινες δραστηριότητες όπως η καύση ορυκτών καυσίμων, η χρήση τεχνητών λιπασμάτων αζώτου και η απελευθέρωση αζώτου στα λύματα έχουν τροποποιήσει δραματικά τον παγκόσμιο κύκλο του αζώτου.[17][18][19] Η ανθρώπινη τροποποίηση του παγκόσμιου κύκλου αζώτου μπορεί να επηρεάσει αρνητικά το σύστημα του φυσικού περιβάλλοντος αλλά και την ανθρώπινη υγεία.[20][21]
Διεργασίες[Επεξεργασία | επεξεργασία κώδικα]
Το άζωτο υπάρχει στο περιβάλλον σε μια μεγάλη ποικιλία χημικών μορφών, συμπεριλαμβανομένου του οργανικού αζώτου, του αμμωνίου (NH+4), των νιτρωδών (NO−2), των νιτρικών (NO−3), του υποξειδίου του αζώτου (N2O), του μονοξειδίου του αζώτου (NO) ή του ανόργανου αερίου αζώτου (N2). Το οργανικό άζωτο μπορεί να έχει τη μορφή ενός ζωντανού οργανισμού, χούμου ή στα ενδιάμεσα προϊόντα της αποσύνθεσης της οργανικής ύλης. Οι διαδικασίες στον κύκλο του αζώτου είναι η μετατροπή του αζώτου από τη μια μορφή σε μία άλλη. Πολλές από αυτές τις διεργασίες πραγματοποιούνται από μικρόβια, είτε στην προσπάθειά τους να συλλέξουν ενέργεια, είτε να συσσωρεύσουν άζωτο σε μια μορφή που απαιτείται για την ανάπτυξή τους. Για παράδειγμα, τα αζωτούχα απόβλητα στα ζωικά ούρα διασπώνται από νιτροποιητικά βακτήρια στο έδαφος για να χρησιμοποιηθούν από τα φυτά. Το διπλανό διάγραμμα δείχνει πώς αυτές οι διεργασίες ταιριάζουν μεταξύ τους για να σχηματίσουν τον κύκλο του αζώτου.
Δέσμευση του αζώτου[Επεξεργασία | επεξεργασία κώδικα]
Η μετατροπή του αερίου αζώτου (N2) σε νιτρικά και νιτρώδη μέσω ατμοσφαιρικών, βιομηχανικών και βιολογικών διεργασιών ονομάζεται αζωτοδέσμευση. Το ατμοσφαιρικό άζωτο πρέπει να υποβληθεί σε επεξεργασία ή αζωτοδέσμευση σε μια χρησιμοποιήσιμη μορφή που θα προσληφθεί από τα φυτά. Δεσμεύονται μεταξύ 5 και 10 δισεκατομμυρία κιλά ετησίως από κεραυνούς, αλλά το μεγαλύτερο μέρος της δέσμευσης γίνεται από ελεύθερα ζωντανά ή συμβιοτικά βακτήρια γνωστά ως διαζότροφα (diazotrophs). Αυτά τα βακτήρια έχουν το ένζυμο αζωτογενάση (nitrogenase) που συνδυάζει το αέριο άζωτο με το υδρογόνο για να παράγει αμμωνία, η οποία μετατρέπεται από τα βακτήρια σε άλλες οργανικές ενώσεις. Το μεγαλύτερο μέρος της βιολογικής δέσμευσης αζώτου συμβαίνει από τη δραστηριότητα της αζωτογενάσης του μολυβδαινίου (Μο), που βρίσκεται σε μια μεγάλη ποικιλία βακτηρίων και σε μερικά αρχαία. Η αζωτογενάση του μολυβδαινίου είναι ένα σύνθετο ένζυμο δύο συστατικών που έχει πολλαπλές προσθετικές ομάδες που περιέχουν μέταλλα.[22] Ένα παράδειγμα βακτηρίων που ζουν ελεύθερα είναι το Azotobacter (αζωτοβακτήρια). Συμβιωτικά βακτήρια που δεσμεύουν το άζωτο όπως το Rhizobium (ριζοβίωμα, ριζοβακτήριο) συνήθως ζουν στους όζους των ριζών των οσπρίων (όπως τα μπιζέλια, η μηδική και τα δέντρα χαρουπιών). Εδώ σχηματίζουν μια σχέση βιολογικής αμοιβαιότητας με το φυτό, παράγοντας αμμωνία με αντάλλαγμα υδατάνθρακες. Λόγω αυτής της σχέσης, τα όσπρια συχνά αυξάνουν την περιεκτικότητα σε άζωτο των φτωχών σε άζωτο εδαφών. Μερικά μη όσπρια μπορούν επίσης να σχηματίσουν τέτοιες συμβιώσεις. Σήμερα, περίπου το 30% του συνολικού δεσμευμένου αζώτου παράγεται βιομηχανικά χρησιμοποιώντας τη διαδικασία Μέθοδος Χάμπερ-Μπος,[23] που χρησιμοποιεί υψηλές θερμοκρασίες και πιέσεις για να μετατρέψει το αέριο άζωτο και μια πηγή υδρογόνου (φυσικό αέριο ή πετρέλαιο) σε αμμωνία.[24]
Αφομοίωση[Επεξεργασία | επεξεργασία κώδικα]
Τα φυτά μπορούν να απορροφήσουν νιτρικά άλατα ή αμμώνιο από το έδαφος από τις τρίχες της ρίζας τους. Εάν το νιτρικό άλας απορροφάται, αρχικά ανάγεται σε ιόντα νιτρώδους και στη συνέχεια σε ιόντα αμμωνίου για ενσωμάτωση σε αμινοξέα, νουκλεϊκά οξέα και χλωροφύλλη. Σε φυτά που έχουν συμβιωτική σχέση με τα ριζόβια, μέρος του αζώτου αφομοιώνεται με τη μορφή ιόντων αμμωνίου απευθείας από τους όζους. Είναι πλέον γνωστό ότι υπάρχει ένας πιο περίπλοκος κύκλος αμινοξέων μεταξύ των βακτηριοειδών Rhizobia και των φυτών. Το φυτό παρέχει αμινοξέα στα βακτηριοειδή, επομένως δεν απαιτείται αφομοίωση της αμμωνίας και τα βακτηριοειδή περνούν αμινοξέα (με το πρόσφατα δεσμευμένο άζωτο) πίσω στο φυτό, σχηματίζοντας έτσι μια αλληλεξαρτώμενη σχέση.[25] Ενώ πολλά ζώα, μύκητες και άλλοι ετερότροφοι οργανισμοί λαμβάνουν άζωτο με την πρόσληψη αμινοξέων, νουκλεοτιδίων και άλλων μικρών οργανικών μορίων, άλλα ετερότροφα (συμπεριλαμβανομένων πολλών βακτηρίων ) είναι σε θέση να χρησιμοποιούν ανόργανες ενώσεις, όπως το αμμώνιο ως μοναδικές πηγές Ν. Η χρήση διαφόρων πηγών Ν ρυθμίζεται προσεκτικά σε όλους τους οργανισμούς.
Αμμωνιοποίηση[Επεξεργασία | επεξεργασία κώδικα]
Όταν ένα φυτό ή ζώο πεθαίνει, ή ένα ζώο διώχνει τα απόβλητα, η αρχική μορφή του αζώτου είναι οργανική. Τα βακτήρια ή οι μύκητες μετατρέπουν το οργανικό άζωτο μέσα στα υπολείμματα ξανά σε αμμώνιο (NH+4), μια διαδικασία που ονομάζεται αμμωνιοποίηση ή ανοργανοποίηση (mineralization). Τα ένζυμα που εμπλέκονται είναι:
- GS: Gln Συνθετάση (κυτοσολικό & πλαστικό)
- GOGAT: Glu 2-οξογλουταρική αμινομεταφοράση (φερρεδοξίνη & εξαρτώμενη από NADH)
- GDH: Glu δεϋδρογονάση:
- Μικρός ρόλος στην αφομοίωση του αμμωνίου.
- Σημαντικό στον καταβολισμό αμινοξέων.

Νιτροποίηση[Επεξεργασία | επεξεργασία κώδικα]
Η μετατροπή του αμμωνίου σε νιτρικό γίνεται κυρίως από βακτήρια που ζουν στο έδαφος και άλλα νιτροποιητικά βακτήρια. Στο αρχικό στάδιο της νιτροποίησης, η οξείδωση του αμμωνίου (NH+4) πραγματοποιείται από βακτήρια όπως το είδος Nitrosomonas, το οποίο μετατρέπει την αμμωνία σε νιτρώδη (NO−2). Άλλα είδη βακτηρίων όπως το νιτροβακτήριο (Nitrobacter), είναι υπεύθυνα για την οξείδωση των νιτρωδών (NO−2) σε νιτρικά (NO−3). Είναι σημαντικό η αμμωνία (NH3) να μετατραπεί σε νιτρικά ή νιτρώδη επειδή η αέρια αμμωνία είναι τοξική για τα φυτά. Λόγω της πολύ υψηλής διαλυτότητάς τους και επειδή τα εδάφη δεν μπορούν να συγκρατήσουν ανιόντα, τα νιτρικά άλατα μπορούν να εισέλθουν σε υπόγεια ύδατα. Τα αυξημένα νιτρικά άλατα στα υπόγεια ύδατα προκαλούν ανησυχία για τη χρήση του πόσιμου νερού, επειδή τα νιτρικά άλατα μπορούν να επηρεάσουν τα επίπεδα οξυγόνου στο αίμα των βρεφών και να προκαλέσουν μεθαιμοσφαιριναιμία ή σύνδρομο γαλάζιου μωρού.[28] Όπου τα υπόγεια ύδατα επαναφορτίζουν τη ροή, τα εμπλουτισμένα με νιτρικά υπόγεια ύδατα μπορούν να συμβάλουν στον ευτροφισμό, μια διαδικασία που οδηγεί σε υψηλό πληθυσμό και ανάπτυξη φυκών, ειδικά πληθυσμούς γαλαζοπράσινων φυκών. Αν και δεν είναι άμεσα τοξικό για τη ζωή των ψαριών, όπως η αμμωνία, τα νιτρικά άλατα μπορεί να έχουν έμμεσες επιπτώσεις στα ψάρια εάν συμβάλλουν σε αυτόν τον ευτροφισμό. Το άζωτο έχει συμβάλει σε σοβαρά προβλήματα ευτροφισμού σε ορισμένα υδατικά συστήματα. Από το 2006, η εφαρμογή λιπάσματος αζώτου ελέγχεται όλο και περισσότερο στη Βρετανία και τις Ηνωμένες Πολιτείες. Αυτό συμβαίνει στην ίδια κατεύθυνση με τον έλεγχο του φωσφορούχου λιπάσματος, ο περιορισμός του οποίου θεωρείται συνήθως απαραίτητος για την ανάκτηση των ευτροφισμένων υδάτινων σωμάτων.
Απονιτροποίηση[Επεξεργασία | επεξεργασία κώδικα]
Απονιτροποίηση είναι η αναγωγή των νιτρικών σε αέριο άζωτο (N2), ολοκληρώνοντας τον κύκλο του αζώτου. Αυτή η διαδικασία εκτελείται από βακτηριακά είδη όπως Pseudomonas και Paracoccus, υπό αναερόβιες συνθήκες. Χρησιμοποιούν τα νιτρικά ως δέκτες ηλεκτρονίων στη θέση του οξυγόνου κατά την αναπνοή. Αυτά τα προαιρετικά αναερόβια βακτήρια μπορούν επίσης να ζήσουν σε αερόβιες συνθήκες. Η απονιτροποίηση συμβαίνει σε αναερόβιες συνθήκες π.χ. σε πλημμυρισμένα εδάφη. Τα απονιτροποιητικά βακτήρια χρησιμοποιούν νιτρικά άλατα στο έδαφος για να πραγματοποιήσουν την αναπνοή και κατά συνέπεια να παράγουν αέριο άζωτο, το οποίο είναι αδρανές και μη διαθέσιμο στα φυτά. Η απονιτροποίηση συμβαίνει σε ελεύθερα ζωντανούς μικροοργανισμούς καθώς και σε υποχρεωτικούς συμβιώτες αναερόβιων βλεφαρίδων.[29]
-
Κλασική αναπαράσταση του κύκλου του αζώτου
-
Ροή αζώτου μέσω του οικοσυστήματος. Τα βακτήρια αποτελούν βασικό στοιχείο του κύκλου, παρέχοντας διαφορετικές μορφές ενώσεων αζώτου που μπορούν να αφομοιωθούν από ανώτερους οργανισμούς
-
Απλή αναπαράσταση του κύκλου του αζώτου. Το γαλάζιο αντιπροσωπεύει αποθήκευση αζώτου, το πράσινο είναι για διαδικασίες που μεταφέρουν άζωτο από το ένα μέρος στο άλλο και το κόκκινο είναι για τα εμπλεκόμενα βακτήρια
Ανομοιωτική αναγωγή νιτρικών σε αμμώνιο[Επεξεργασία | επεξεργασία κώδικα]
Η ανομοιωτική αναγωγή νιτρικών σε αμμώνιο (DNRA), ή η αμμωνιοποίηση νιτρικών/νιτρωδών, είναι μια διαδικασία αναερόβιας αναπνοής. Τα μικρόβια που αναλαμβάνουν το DNRA οξειδώνουν την οργανική ύλη και χρησιμοποιούν νιτρικά ως δέκτες ηλεκτρονίων, ανάγοντάς τα σε νιτρώδη και μετά σε αμμώνιο (NO−3 → NO−2 → NH+4).[30] Τόσο τα βακτήρια απονιτροποίησης όσο και τα βακτήρια αμμωνιοποίησης νιτρικών θα ανταγωνίζονται για τα νιτρικά άλατα στο περιβάλλον, αν και το DNRA δρα για τη διατήρηση του βιοδιαθέσιμου αζώτου ως διαλυτού αμμωνίου αντί για την παραγωγή αερίου διαζώτου.[31]
Αναερόβια οξείδωση αμμωνίας (Anammox)[Επεξεργασία | επεξεργασία κώδικα]
Η διαδικασία Anammox είναι μια συναναλογική (comproportionation) αντίδραση οξειδοαναγωγής, στην οποία η αμμωνία (το αναγωγικό μέσο που δίνει ηλεκτρόνια) και το νιτρώδες ιόν (το οξειδωτικό μέσο που δέχεται ηλεκτρόνια) μεταφέρουν τρία ηλεκτρόνια και μετατρέπονται σε ένα μόριο διατομικού αερίου αζώτου (N2) και δύο μορίων νερού. Αυτή η διαδικασία αποτελεί ένα σημαντικό ποσοστό της μετατροπής του αζώτου στους ωκεανούς. Ο εξισορροπημένος τύπος στοιχειομετρίας για τη χημική αντίδραση ANAMMOX μπορεί να γραφτεί ως εξής, όπου ένα ιόν αμμωνίου περιλαμβάνει το μόριο αμμωνίας, τη συζυγή του βάση:
- NH+4 + NO−2 → N2 + 2 H2O (ΔG° = −357 kJ⋅mol−1).[32]
Αυτή είναι μια εξώεργη διεργασία (εδώ επίσης μια εξώθερμη αντίδραση) που απελευθερώνει ενέργεια, όπως υποδεικνύεται από την αρνητική τιμή του ΔG°, τη διαφορά στην ελεύθερη ενέργεια Γκιμπς μεταξύ των προϊόντων της αντίδρασης και των αντιδρώντων.
Άλλες διεργασίες[Επεξεργασία | επεξεργασία κώδικα]
Αν και η δέσμευση αζώτου είναι η κύρια πηγή αζώτου που διατίθεται στα φυτά στα περισσότερα οικοσυστήματα, σε περιοχές με πλούσιο υπόβαθρο πετρώματος σε άζωτο, η διάσπαση αυτού του πετρώματος χρησιμεύει επίσης ως πηγή αζώτου.[33][34][35] Η αναγωγή νιτρικών είναι επίσης μέρος του κύκλου του σιδήρου, υπό ανοξικές συνθήκες ο Fe(II) μπορεί να δώσει ένα ηλεκτρόνιο στο NO−3 και οξειδώνεται σε Fe(III), ενώ το {{chem2|NO3-} } ανάγεται σε NO−2, N2O, N2 και NH+4 ανάλογα με τις συνθήκες και τα μικροβιακά είδη που εμπλέκονται.[36] Τα κόπρανα των κητοειδών λειτουργούν επίσης ως σύνδεσμος στον κύκλο θαλάσσιου αζώτου, συγκεντρώνοντας άζωτο στις επιπελαγικές ζώνες των ωκεάνιων περιβαλλόντων πριν από τη διασπορά του σε διάφορα θαλάσσια στρώματα, ενισχύοντας τελικά την πρωτογενή παραγωγικότητα των ωκεανών.[37]
Κύκλος θαλάσσιου αζώτου[Επεξεργασία | επεξεργασία κώδικα]


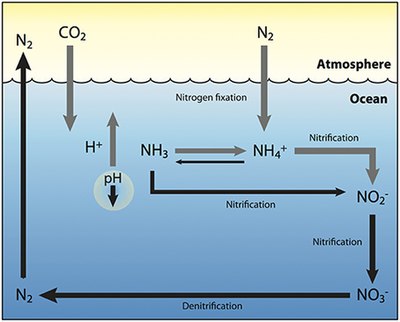
Ο κύκλος του αζώτου είναι μια σημαντική διαδικασία και στον ωκεανό. Ενώ ο συνολικός κύκλος είναι παρόμοιος, υπάρχουν διαφορετικοί παίκτες [40] και τρόποι μεταφοράς του αζώτου στον ωκεανό. Το άζωτο εισέρχεται στο νερό μέσω της καθίζησης, της απορροής ή ως N2 από την ατμόσφαιρα. Το άζωτο δεν μπορεί να χρησιμοποιηθεί από το φυτοπλαγκτόν ως N2, επομένως πρέπει να υποβληθεί σε δέσμευση αζώτου, η οποία πραγματοποιείται κυρίως από κυανοβακτήρια.[41] Χωρίς αποθέματα δεσμευμένου αζώτου που εισέρχονται στον θαλάσσιο κύκλο, το δεσμευμένο άζωτο θα εξαντληθεί σε περίπου 2000 χρόνια.[42] Το φυτοπλαγκτόν χρειάζεται άζωτο σε βιολογικά διαθέσιμες μορφές για την αρχική σύνθεση της οργανικής ύλης. Η αμμωνία και η ουρία απελευθερώνονται στο νερό με απέκκριση από το πλαγκτόν. Οι πηγές αζώτου απομακρύνονται από την ευφωτική ζώνη με την προς τα κάτω κίνηση της οργανικής ύλης. Αυτό μπορεί να συμβεί από βύθιση φυτοπλαγκτού, κάθετη ανάμειξη ή βύθιση αποβλήτων των καθέτων μεταναστών. Η βύθιση έχει ως αποτέλεσμα την εισαγωγή αμμωνίας σε χαμηλότερα βάθη κάτω από την ευφωτική ζώνη. Τα βακτήρια είναι σε θέση να μετατρέψουν την αμμωνία σε νιτρώδη και νιτρικά άλατα, αλλά αναστέλλονται από το φως, επομένως αυτό πρέπει να συμβεί κάτω από την ευφωτική ζώνη.[43] Η αμμωνοποίηση ή ορυκτοποίηση εκτελείται από βακτήρια για τη μετατροπή του οργανικού αζώτου σε αμμωνία. Νιτροποίηση μπορεί να συμβεί στη συνέχεια για να μετατραπεί το αμμώνιο σε νιτρώδες και νιτρικό.[44] Τα νιτρικά άλατα μπορούν να επιστρέψουν στην ευφωτική ζώνη με κατακόρυφη ανάμειξη και ανύψωση όπου μπορεί να προσληφθεί από το φυτοπλαγκτόν για να συνεχιστεί ο κύκλος. Το N2 μπορεί να επιστραφεί στην ατμόσφαιρα μέσω απονιτροποίησης (denitrification). Το αμμώνιο θεωρείται ότι είναι η προτιμώμενη πηγή δεσμευμένου αζώτου για το φυτοπλαγκτόν, επειδή η αφομοίωσή του δεν περιλαμβάνει αντίδραση οξειδοαναγωγής και επομένως απαιτεί λίγη ενέργεια. Τα νιτρικά απαιτούν μια αντίδραση οξειδοαναγωγής για αφομοίωση, αλλά είναι πιο άφθονα, επομένως το μεγαλύτερο μέρος του φυτοπλαγκτόν έχει προσαρμοστεί έτσι ώστε να έχει τα απαραίτητα ένζυμα για την πραγματοποίηση αυτής της αναγωγής (νιτρική αναγωγάση (nitrate reductase)). Υπάρχουν μερικές αξιοσημείωτες και γνωστές εξαιρέσεις που περιλαμβάνουν τα περισσότερα Προχλωρόκοκκος (Prochlorococcus) και μερικά Συνεχόκοκκος (Synechococcus) που μπορούν να προσλάβουν άζωτο μόνο ως αμμώνιο.[42] Τα θρεπτικά συστατικά στον ωκεανό δεν είναι ομοιόμορφα κατανεμημένα. Οι περιοχές ανύψωσης παρέχουν προμήθειες αζώτου κάτω από την ευφωτική ζώνη. Οι παράκτιες ζώνες παρέχουν άζωτο από την απορροή και η ανύψωση εμφανίζεται εύκολα κατά μήκος της ακτής. Ωστόσο, ο ρυθμός με τον οποίο μπορεί να προσληφθεί άζωτο από το φυτοπλαγκτόν μειώνεται στα ολιγοτροφικά νερά όλο το χρόνο και στα εύκρατα νερά το καλοκαίρι με αποτέλεσμα χαμηλότερη πρωτογενή παραγωγή.[45] Η κατανομή των διαφορετικών μορφών αζώτου ποικίλλει επίσης στους ωκεανούς. Τα νιτρικά άλατα εξαντλούνται σε ύδατα κοντά στην επιφάνεια, εκτός από τις περιοχές ανύψωσης. Οι παράκτιες περιοχές ανύψωσης έχουν συνήθως υψηλά επίπεδα νιτρικών και χλωροφύλλης ως αποτέλεσμα της αυξημένης παραγωγής. Ωστόσο, υπάρχουν περιοχές με υψηλή περιεκτικότητα σε νιτρικά άλατα, αλλά χαμηλή σε χλωροφύλλη που αναφέρονται ως περιοχές HNLC υψηλού αζώτου, χαμηλής χλωροφύλλης (high nitrogen, low chlorophyll, HNLC). Η καλύτερη εξήγηση για τις περιοχές HNLC σχετίζεται με την έλλειψη σιδήρου στον ωκεανό, η οποία μπορεί να διαδραματίσει σημαντικό ρόλο στη δυναμική των ωκεανών και στους κύκλους θρεπτικών συστατικών. Η εισροή του σιδήρου ποικίλλει ανάλογα με την περιοχή και μεταφέρεται στον ωκεανό από τη σκόνη (από αμμοθύελλα) και την έκπλυση από τους βράχους. Ο σίδηρος εξετάζεται ως το πραγματικό περιοριστικό στοιχείο για την παραγωγικότητα των οικοσυστημάτων στον ωκεανό. Το αμμώνιο και τα νιτρώδη παρουσιάζουν μέγιστη συγκέντρωση στα 50–80 m (κάτω άκρο της ευφωτικής ζώνης) με φθίνουσα συγκέντρωση κάτω από αυτό το βάθος. Αυτή η κατανομή μπορεί να οφείλεται στο γεγονός ότι τα νιτρώδη και το αμμώνιο είναι ενδιάμεσα είδη. Και τα δύο παράγονται και καταναλώνονται γρήγορα μέσω της στήλης του νερού.[42] Η ποσότητα του αμμωνίου στον ωκεανό είναι περίπου 3 τάξεις μεγέθους μικρότερη από τα νιτρικά.[42] Μεταξύ αμμωνίου, νιτρωδών και νιτρικών, τα νιτρώδη έχουν τον ταχύτερο ρυθμό αναπλήρωσης. Μπορεί να παραχθεί κατά την αφομοίωση των νιτρικών, τη νιτροποίηση και την απονιτροποίηση. Καταναλώνεται όμως αμέσως ξανά.
Νέο έναντι αναγεννημένου αζώτου[Επεξεργασία | επεξεργασία κώδικα]
Το άζωτο που εισέρχεται στην ευφωτική ζώνη αναφέρεται ως νέο άζωτο, επειδή έρχεται πρόσφατα έξω από το παραγωγικό στρώμα.[41] Το νέο άζωτο μπορεί να προέρχεται από κάτω από την ευφωτική ζώνη ή από εξωτερικές πηγές. Οι εξωτερικές πηγές αναβλύζουν από βαθιά νερά και δέσμευση αζώτου. Εάν η οργανική ύλη καταναλωθεί, αναπνεύσει, παραδοθεί στο νερό ως αμμωνία και επανενσωματωθεί στην οργανική ύλη από το φυτοπλαγκτόν, θεωρείται ανακυκλωμένη/αναγεννημένη παραγωγή. Η νέα παραγωγή αποτελεί σημαντικό συστατικό του θαλάσσιου περιβάλλοντος. Ένας λόγος είναι ότι μόνο η συνεχής εισαγωγή νέου αζώτου μπορεί να καθορίσει τη συνολική ικανότητα του ωκεανού να παράγει μια βιώσιμη συγκομιδή ψαριών.[45] Η συγκομιδή ψαριών από περιοχές αναγεννημένου αζώτου θα οδηγήσει σε μείωση του αζώτου και συνεπώς σε μείωση της πρωτογενούς παραγωγής. Αυτό θα έχει αρνητικές επιπτώσεις στο σύστημα. Ωστόσο, εάν τα ψάρια συλλέγονται από περιοχές με νέο άζωτο, το άζωτο θα αναπληρωθεί.
Μελλοντική οξίνιση[Επεξεργασία | επεξεργασία κώδικα]
Όπως φαίνεται από το διάγραμμα στα δεξιά, επιπλέον διοξείδιο του άνθρακα (CO2) απορροφάται από τον ωκεανό και αντιδρά με το νερό, ανθρακικό οξύ (H 2CO3) σχηματίζεται και διασπάται σε διττανθρακικά ιόντα (HCO−3) και υδρογονοϊόντα (H+) (γκρι βέλος), το οποίο μειώνει τα βιοδιαθέσιμα ανθρακικά (CO2−3) και μειώνει το pH του ωκεανού (μαύρο βέλος). Αυτό είναι πιθανό να ενισχύσει τη δέσμευση του αζώτου με διαζότροφα (diazotrophs) (γκρι βέλος), τα οποία χρησιμοποιούν ιόντα H+ για να μετατρέψουν το άζωτο σε βιοδιαθέσιμες μορφές όπως αμμωνία (NH 3) και ιόντα αμμωνίου (NH+4). Ωστόσο, καθώς το pH μειώνεται και περισσότερη αμμωνία μετατρέπεται σε ιόντα αμμωνίου (γκρι βέλος), υπάρχει λιγότερη οξείδωση της αμμωνίας σε νιτρώδη (NO–
2), με αποτέλεσμα τη συνολική μείωση της νιτροποίησης και της απονιτροποίησης (μαύρα βέλη). Αυτό με τη σειρά του θα οδηγούσε σε περαιτέρω συσσώρευση δεσμευμένου αζώτου στον ωκεανό, με πιθανή συνέπεια τον ευτροφισμό. Τα γκρι βέλη αντιπροσωπεύουν αύξηση, ενώ τα μαύρα βέλη αντιπροσωπεύουν μείωση στη σχετική διαδικασία.[39]
Ανθρώπινες επιρροές στον κύκλο του αζώτου[Επεξεργασία | επεξεργασία κώδικα]


Ως αποτέλεσμα της εκτεταμένης καλλιέργειας οσπρίων (ιδιαίτερα σόγιας, μηδικής και τριφυλλιού), η αυξανόμενη χρήση της μεθόδου Χάμπερ-Μπος στην παραγωγή χημικών λιπασμάτων και η ρύπανση που εκπέμπεται από οχήματα και βιομηχανικές εγκαταστάσεις, οι άνθρωποι έχουν υπερδιπλασιάσει την ετήσια μεταφορά αζώτου σε βιολογικά διαθέσιμες μορφές.[28] Επιπλέον, οι άνθρωποι έχουν συμβάλει σημαντικά στη μεταφορά ιχνών αερίων αζώτου από τη Γη στην ατμόσφαιρα και από την ξηρά στα υδάτινα συστήματα. Οι ανθρώπινες αλλαγές στον παγκόσμιο κύκλο του αζώτου είναι πιο έντονες στις ανεπτυγμένες χώρες και στην Ασία, όπου οι εκπομπές οχημάτων και η βιομηχανική γεωργία είναι οι υψηλότερες.[46] Η παραγωγή Nr, δραστικού αζώτου (reactive nitrogen, Nr), έχει αυξηθεί πάνω από 10 φορές τον περασμένο αιώνα λόγω της παγκόσμιας βιομηχανοποίησης.[2][47] Αυτή η μορφή αζώτου ακολουθεί μια αλληλουχία αντιδράσεων μέσω της βιόσφαιρας μέσω μιας ποικιλίας μηχανισμών, και συσσωρεύεται καθώς ο ρυθμός παραγωγής του είναι μεγαλύτερος από τον ρυθμό απονιτροποίησης.[48] Το υποξείδιο του αζώτου (N2O) έχει αυξηθεί στην ατμόσφαιρα ως αποτέλεσμα της γεωργικής λίπανσης, της καύσης βιομάζας, των βοοειδών και των μονάδων πάχυνσης καθώς και των βιομηχανικών πηγών.[49] Το N2O έχει επιβλαβείς επιπτώσεις στην στρατόσφαιρα, όπου διασπάται και δρα ως καταλύτης στην καταστροφή του ατμοσφαιρικού όζοντος. Το υποξείδιο του αζώτου είναι επίσης ένα αέριο του θερμοκηπίου και είναι επί του παρόντος ο τρίτος μεγαλύτερος παράγοντας υπερθέρμανσης του πλανήτη, μετά το διοξείδιο του άνθρακα και το μεθάνιο. Αν και δεν είναι τόσο άφθονο στην ατμόσφαιρα όσο το διοξείδιο του άνθρακα, είναι, για ισοδύναμη μάζα, σχεδόν 300 φορές πιο ισχυρό στην ικανότητά του να θερμαίνει τον πλανήτη.[50] Η αμμωνία (NH3) στην ατμόσφαιρα έχει τριπλασιαστεί ως αποτέλεσμα των ανθρώπινων δραστηριοτήτων. Είναι ένα αντιδραστήριο στην ατμόσφαιρα, όπου δρα ως αερόλυμα, μειώνοντας την ποιότητα του αέρα και προσκολλάται σε σταγονίδια νερού, καταλήγοντας τελικά σε νιτρικό οξύ (ΗΝΟ 3) που παράγει όξινη βροχή. Η ατμοσφαιρική αμμωνία και το νιτρικό οξύ βλάπτουν επίσης το αναπνευστικό σύστημα. Η πολύ υψηλή θερμοκρασία του κεραυνού παράγει φυσικά μικρές ποσότητες NOx, NH3 και HNO3, αλλά σε υψηλή θερμοκρασία καύσης έχει συμβάλει σε μια 6- ή 7-πλάσια αύξηση της ροής του NOx στην ατμόσφαιρα. Η παραγωγή του είναι συνάρτηση της θερμοκρασίας καύσης - όσο υψηλότερη είναι η θερμοκρασία, τόσο περισσότερο NOx παράγεται. Η καύση ορυκτών καυσίμων συμβάλλει πρωταρχικά, αλλά επίσης και τα βιοκαύσιμα, ακόμη και η καύση υδρογόνου. Ωστόσο, ο ρυθμός απευθείας έγχυσης υδρογόνου στους θαλάμους καύσης των κινητήρων εσωτερικής καύσης μπορεί να ελεγχθεί για να αποφευχθούν οι υψηλότερες θερμοκρασίες καύσης που παράγουν NOx. Η αμμωνία και τα οξείδια του αζώτου μεταβάλλουν ενεργά την ατμοσφαιρική χημεία. Είναι πρόδρομοι της παραγωγής όζοντος στην τροπόσφαιρα (κατώτερη ατμόσφαιρα), η οποία συμβάλλει στην αιθαλομίχλη και την όξινη βροχή, βλάπτει φυτά και αυξάνει τις εισροές αζώτου στα οικοσυστήματα. Οι διαδικασίες οικοσυστημάτων μπορούν να αυξηθούν με τη αζωτούχα λίπανση, αλλά η ανθρωπογενής εισροή μπορεί επίσης να οδηγήσει σε κορεσμό του αζώτου, ο οποίος εξασθενεί την παραγωγικότητα και μπορεί να βλάψει την υγεία των φυτών, των ζώων, των ψαριών , και των ανθρώπων.[28] Μειώσεις στη βιοποικιλότητα μπορεί επίσης να προκύψουν εάν η υψηλότερη διαθεσιμότητα αζώτου αυξήσει τα χόρτα που απαιτούν άζωτο, προκαλώντας υποβάθμιση των φτωχών σε άζωτο, με ποικιλία ειδών από ρείκια.[51]
Συνέπεια της ανθρώπινης τροποποίησης του κύκλου του αζώτου[Επεξεργασία | επεξεργασία κώδικα]

Επιπτώσεις στα φυσικά συστήματα[Επεξεργασία | επεξεργασία κώδικα]
Τα αυξανόμενα επίπεδα εναπόθεσης αζώτου αποδεικνύεται ότι έχουν μια σειρά αρνητικών επιπτώσεων τόσο στο χερσαίο όσο και στα υδάτινα οικοσυστήματα.[52][53] Τα αέρια αζώτου και τα αερολύματα μπορεί να είναι άμεσα τοξικά για ορισμένα φυτικά είδη, επηρεάζοντας την υπέργεια φυσιολογία και την ανάπτυξη των φυτών κοντά σε μεγάλες σημειακές πηγές αζωτορρύπανσης. Μπορεί επίσης να συμβούν αλλαγές στα φυτικά είδη, καθώς η συσσώρευση ενώσεων αζώτου αυξάνει τη διαθεσιμότητά του σε ένα δεδομένο οικοσύστημα, αλλάζοντας τελικά τη σύνθεση των ειδών, την ποικιλότητα των φυτών και τον κύκλο του αζώτου. Η αμμωνία και το αμμώνιο – δύο αναγμένες μορφές αζώτου – μπορεί να είναι επιζήμιες με την πάροδο του χρόνου λόγω της αυξημένης τοξικότητας για ευαίσθητα είδη φυτών,[54] ιδιαίτερα εκείνων που έχουν συνηθίσει να χρησιμοποιούν νιτρικά ως πηγή αζώτου, προκαλώντας κακή ανάπτυξη των ριζών και των βλαστών τους. Η αυξημένη εναπόθεση αζώτου οδηγεί επίσης σε οξίνιση του εδάφους, η οποία αυξάνει την έκπλυση κατιόντων βάσης στο έδαφος και των ποσοτήτων αργιλίου και άλλα δυνητικά τοξικά μέταλλα μαζί με τη μείωση της ποσότητας νιτροποίησης που εμφανίζεται και την αύξηση των φυτικών απορριμμάτων. Λόγω των συνεχιζόμενων αλλαγών που προκαλούνται από την υψηλή εναπόθεση αζώτου, η ευαισθησία ενός περιβάλλοντος σε οικολογική καταπόνηση και διαταραχές –όπως παράσιτα και παθογόνα μπορεί να αυξηθεί, καθιστώντας λιγότερο ανθεκτικό σε καταστάσεις που διαφορετικά θα είχαν μικρό αντίκτυπο στη μακροχρόνια ζωτικότητα. Οι πρόσθετοι κίνδυνοι που εγκυμονεί η αυξημένη διαθεσιμότητα ανόργανου αζώτου στα υδάτινα οικοσυστήματα περιλαμβάνουν την οξίνιση του νερού, τον ευτροφισμό συστημάτων γλυκού και αλμυρού νερού και ζητήματα τοξικότητας για τα ζώα, συμπεριλαμβανομένων των ανθρώπων.[55] Ο ευτροφισμός οδηγεί συχνά σε χαμηλότερα επίπεδα διαλυμένου οξυγόνου στη στήλη του νερού, συμπεριλαμβανομένων των υποξικών και ανοξικών συνθηκών, που μπορεί να προκαλέσουν θάνατο της υδρόβιας πανίδας. Το σχετικά ακίνητο βένθος, ή τα πλάσματα που κατοικούν στον βυθό, είναι ιδιαίτερα ευάλωτα λόγω της έλλειψης κινητικότητάς τους, αν και οι θανατώσεις μεγάλων ψαριών δεν είναι ασυνήθιστοι. Οι ωκεάνιες νεκρές ζώνες κοντά στις εκβολές του Μισισιπή στον Κόλπο του Μεξικού είναι ένα πολύ γνωστό παράδειγμα υποξίας που προκαλείται από άνθιση φυτοπλαγκτού.[56][57] Τα Adirondack Lake, Catskills, Hudson Highlands, Rensselaer Plateau της Νέας Υόρκης και τμήματα του Λονγκ Άιλαντ εμφανίζουν τον αντίκτυπο της εναπόθεσης νιτρικής όξινης βροχής, με αποτέλεσμα τη θανάτωση ψαριών και πολλών άλλων υδρόβιων ειδών.[58] Η αμμωνία (NH3) είναι εξαιρετικά τοξική για τα ψάρια και το επίπεδο αμμωνίας που απορρίπτεται από εγκαταστάσεις επεξεργασίας λυμάτων πρέπει να παρακολουθείται στενά. Για την αποφυγή θανάτων ψαριών, είναι συχνά επιθυμητή η νιτροποίηση μέσω αερισμού πριν από την απόρριψη. Η επίγεια εφαρμογή μπορεί να είναι μια ελκυστική εναλλακτική λύση στον αερισμό.
Επιπτώσεις στην ανθρώπινη υγεία: συσσώρευση νιτρικών στο πόσιμο νερό[Επεξεργασία | επεξεργασία κώδικα]
Η διαρροή του δραστικού αζώτου από ανθρώπινες δραστηριότητες μπορεί να προκαλέσει συσσώρευση νιτρικών στο φυσικό υδάτινο περιβάλλον, γεγονός που μπορεί να προκαλέσει επιβλαβείς επιπτώσεις στην ανθρώπινη υγεία. Η υπερβολική χρήση λιπασμάτων αζώτου στη γεωργία είναι μία από τις κύριες πηγές νιτρορύπανσης στα υπόγεια και επιφανειακά ύδατα.[59][60] Λόγω της υψηλής διαλυτότητάς τους και της χαμηλής κατακράτησης στο έδαφος, τα νιτρικά άλατα μπορούν εύκολα να διαφύγουν από το στρώμα του υπεδάφους στα υπόγεια ύδατα, προκαλώντας νιτρορύπανση. Ορισμένες άλλες μη σημειακές πηγές για τη νιτρορύπανση στα υπόγεια ύδατα προέρχονται από τη διατροφή των ζώων, τη μόλυνση των ζώων και των ανθρώπων και τα αστικά και βιομηχανικά απόβλητα. Δεδομένου ότι τα υπόγεια ύδατα χρησιμεύουν συχνά ως κύρια παροχή νερού οικιακής χρήσης, η νιτρορύπανση μπορεί να επεκταθεί από τα υπόγεια ύδατα στα επιφανειακά και στο πόσιμο νερό κατά τη διαδικασία παραγωγής πόσιμοy νερού, ειδικά για μικρές κοινοτικές παροχές νερού, όπου δεν ρυθμίζονται καλά και χρησιμοποιούνται ανθυγιεινά νερά.[61] Το πρότυπο του ΠΟΥ για το πόσιμο νερό είναι 50 mg NO−3 L−1 για βραχυπρόθεσμη έκθεση και για χρόνιες επιδράσεις 3 mg NO−3 L−1.[62] Μόλις εισέλθει στο ανθρώπινο σώμα, τα νιτρικά άλατα μπορούν να αντιδράσουν με οργανικές ενώσεις μέσω αντιδράσεων νιτροζυλίωσης στο στομάχι για να σχηματιστούν νιτροζαμίνες και νιτροζαμίδια, τα οποία εμπλέκονται σε ορισμένους τύπους καρκίνου (π.χ., καρκίνος του στόματος (oral cancer) και καρκίνος του στομάχου).[63]
Επιπτώσεις στην ανθρώπινη υγεία: ποιότητα αέρα[Επεξεργασία | επεξεργασία κώδικα]
Οι ανθρώπινες δραστηριότητες έχουν επίσης αλλάξει δραματικά τον παγκόσμιο κύκλο αζώτου μέσω της παραγωγής αζωτούχων αερίων, που συνδέονται με την παγκόσμια ατμοσφαιρική αζωτούχα ρύπανση. Υπάρχουν πολλές πηγές ατμοσφαιρικών ροών ενεργού αζώτου (Nr). Οι γεωργικές πηγές ενεργού αζώτου μπορούν να παράγουν ατμοσφαιρικές εκπομπές αμμωνίας (NH3), οξειδίων του αζώτου (NOx) και υποξειδίου του αζώτου (N2O). Οι διεργασίες καύσης στην παραγωγή ενέργειας, τη μεταφορά και τη βιομηχανία μπορούν επίσης να οδηγήσουν στο σχηματισμό νέου ενεργού αζώτου μέσω της εκπομπής NOx, μη σκόπιμων αποβλήτων. Όταν αυτά τα δραστικά άζωτα απελευθερώνονται στην κατώτερη ατμόσφαιρα, μπορούν να προκαλέσουν το σχηματισμό αιθαλομίχλης, σωματιδίων και αερολυμάτων, τα οποία συμβάλλουν σημαντικά στις δυσμενείς επιπτώσεις στην υγεία του ανθρώπου από την ατμοσφαιρική ρύπανση.[64] Στην ατμόσφαιρα, το NO2 μπορεί να οξειδωθεί σε νιτρικό οξύ (HNO3) και μπορεί περαιτέρω να αντιδράσει με την NH3 για να σχηματίσει νιτρικό αμμώνιο (NH4NO3), το οποίο διευκολύνει τον σχηματισμό σωματιδιακών νιτρικών. Επιπλέον, η NH3 μπορεί να αντιδράσει με άλλα όξινα αέρια (θειικά και υδροχλωρικά) για να σχηματίσει σωματίδια που περιέχουν αμμώνιο, τα οποία είναι οι πρόδρομοι για τα δευτερεύοντα σωματίδια οργανικού αερολύματος σε φωτοχημική αιθαλομίχλη.[65]
Παραπομπές[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Fowler, David; Coyle, Mhairi; Skiba, Ute; Sutton, Mark A.; Cape, J. Neil; Reis, Stefan; Sheppard, Lucy J.; Jenkins, Alan και άλλοι. (5 July 2013). «The global nitrogen cycle in the twenty-first century». Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences 368 (1621): 20130164. doi:. PMID 23713126.
- ↑ 2,0 2,1 Galloway, J. N.; Townsend, A. R.; Erisman, J. W.; Bekunda, M.; Cai, Z.; Freney, J. R.; Martinelli, L. A.; Seitzinger, S. P. και άλλοι. (2008). «Transformation of the Nitrogen Cycle: Recent Trends, Questions, and Potential Solutions». Science 320 (5878): 889–892. doi:. ISSN 0036-8075. PMID 18487183. Bibcode: 2008Sci...320..889G. http://156.35.33.98/ranadon/Ricardo_Anadon/docencia/DoctoradoEconomia/241eGallowayNitrogenTrend08.pdf. Ανακτήθηκε στις 2019-09-23.
- ↑ Vitousek, P. M.; Menge, D. N. L.; Reed, S. C.; Cleveland, C. C. (2013). «Biological nitrogen fixation: rates, patterns and ecological controls in terrestrial ecosystems». Philosophical Transactions of the Royal Society B: Biological Sciences 368 (1621): 20130119. doi:. PMID 23713117.
- ↑ 4,0 4,1 Voss, M.; Bange, H. W.; Dippner, J. W.; Middelburg, J. J.; Montoya, J. P.; Ward, B. (2013). «The marine nitrogen cycle: recent discoveries, uncertainties and the potential relevance of climate change». Philosophical Transactions of the Royal Society B: Biological Sciences 368 (1621): 20130121. doi:. PMID 23713119.
- ↑ 5,0 5,1 Fowler, David; Coyle, Mhairi; Skiba, Ute; Sutton, Mark A.; Cape, J. Neil; Reis, Stefan; Sheppard, Lucy J.; Jenkins, Alan και άλλοι. (5 July 2013). «The global nitrogen cycle in the twenty-first century». Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences 368 (1621): 20130164. doi:. PMID 23713126.
- ↑ Vuuren, Detlef P van; Bouwman, Lex F; Smith, Steven J; Dentener, Frank (2011). «Global projections for anthropogenic reactive nitrogen emissions to the atmosphere: an assessment of scenarios in the scientific literature». Current Opinion in Environmental Sustainability 3 (5): 359–369. doi:. ISSN 1877-3435. Bibcode: 2011COES....3..359V.
- ↑ Pilegaard, K. (2013). «Processes regulating nitric oxide emissions from soils». Philosophical Transactions of the Royal Society B: Biological Sciences 368 (1621): 20130126. doi:. PMID 23713124.
- ↑ Levy, H.; Moxim, W. J.; Kasibhatla, P. S. (1996). «A global three-dimensional time-dependent lightning source of tropospheric NOx». Journal of Geophysical Research: Atmospheres 101 (D17): 22911–22922. doi:. ISSN 0148-0227. Bibcode: 1996JGR...10122911L.
- ↑ Sutton, M. A.; Reis, S.; Riddick, S. N.; Dragosits, U.; Nemitz, E.; Theobald, M. R.; Tang, Y. S.; Braban, C. F. και άλλοι. (2013). «Towards a climate-dependent paradigm of ammonia emission and deposition». Philosophical Transactions of the Royal Society B: Biological Sciences 368 (1621): 20130166. doi:. PMID 23713128.
- ↑ Dentener, F.; Drevet, J.; Lamarque, J. F.; Bey, I.; Eickhout, B.; Fiore, A. M.; Hauglustaine, D.; Horowitz, L. W. και άλλοι. (2006). «Nitrogen and sulfur deposition on regional and global scales: a multimodel evaluation» (στα αγγλικά). Global Biogeochemical Cycles 20 (4): n/a. doi:. Bibcode: 2006GBioC..20.4003D. https://hal.archives-ouvertes.fr/hal-00342326/file/Dentener_et_al-2006-Global_Biogeochemical_Cycles.pdf.
- ↑ 11,0 11,1 11,2 Duce, R. A.; LaRoche, J.; Altieri, K.; Arrigo, K. R.; Baker, A. R.; Capone, D. G.; Cornell, S.; Dentener, F. και άλλοι. (2008). «Impacts of Atmospheric Anthropogenic Nitrogen on the Open Ocean». Science 320 (5878): 893–7. doi:. PMID 18487184. Bibcode: 2008Sci...320..893D.
- ↑ Bouwman, L.; Goldewijk, K. K.; Van Der Hoek, K. W.; Beusen, A. H. W.; Van Vuuren, D. P.; Willems, J.; Rufino, M. C.; Stehfest, E. (2011-05-16). «Exploring global changes in nitrogen and phosphorus cycles in agriculture induced by livestock production over the 1900-2050 period». Proceedings of the National Academy of Sciences 110 (52): 20882–7. doi:. PMID 21576477.
- ↑ Solomon, Susan (2007). Climate change 2007 : the physical science basis. Published for the Intergovernmental Panel on Climate Change [by] Cambridge University Press. ISBN 9780521880091. OCLC 228429704.
- ↑ Sutton, Mark A., επιμ. (14 Απριλίου 2011). The European nitrogen assessment : sources, effects, and policy perspectives. Cambridge University Press. ISBN 9781107006126. OCLC 690090202.
- ↑ Deutsch, Curtis; Sarmiento, Jorge L.; Sigman, Daniel M.; Gruber, Nicolas; Dunne, John P. (2007). «Spatial coupling of nitrogen inputs and losses in the ocean». Nature 445 (7124): 163–167. doi:. ISSN 0028-0836. PMID 17215838. Bibcode: 2007Natur.445..163D.
- ↑ Steven B. Carroll· Steven D. Salt (2004). [[[:Πρότυπο:GBurl]] Ecology for gardeners] Check
|url=value (βοήθεια). Timber Press. σελ. 93. ISBN 978-0-88192-611-8. - ↑ Kuypers, MMM; Marchant, HK; Kartal, B (2011). «The Microbial Nitrogen-Cycling Network». Nature Reviews Microbiology 1 (1): 1–14. doi:. PMID 29398704.
- ↑ Galloway, J. N. (2004). «Nitrogen cycles: past, present, and future generations». Biogeochemistry 70 (2): 153–226. doi:.
- ↑ Reis, Stefan; Bekunda, Mateete; Howard, Clare M; Karanja, Nancy; Winiwarter, Wilfried; Yan, Xiaoyuan; Bleeker, Albert; Sutton, Mark A (2016-12-01). «Synthesis and review: Tackling the nitrogen management challenge: from global to local scales». Environmental Research Letters 11 (12): 120205. doi:. ISSN 1748-9326. Bibcode: 2016ERL....11l0205R.
- ↑ Gu, Baojing; Ge, Ying; Ren, Yuan; Xu, Bin; Luo, Weidong; Jiang, Hong; Gu, Binhe; Chang, Jie (2012-08-17). «Atmospheric Reactive Nitrogen in China: Sources, Recent Trends, and Damage Costs». Environmental Science & Technology 46 (17): 9420–9427. doi:. ISSN 0013-936X. PMID 22852755. Bibcode: 2012EnST...46.9420G.
- ↑ Kim, Haryun; Lee, Kitack; Lim, Dhong-Il; Nam, Seung-Il; Kim, Tae-Wook; Yang, Jin-Yu T.; Ko, Young Ho; Shin, Kyung-Hoon και άλλοι. (2017-05-11). «Widespread Anthropogenic Nitrogen in Northwestern Pacific Ocean Sediment». Environmental Science & Technology 51 (11): 6044–52. doi:. ISSN 0013-936X. PMID 28462990. Bibcode: 2017EnST...51.6044K.
- ↑ Moir, JWB, επιμ. (2011). Nitrogen Cycling in Bacteria: Molecular Analysis. Caister Academic Press. ISBN 978-1-904455-86-8.
- ↑ Smith, B.· Richards, R.L.· Newton, W.E. (2013). [[[:Πρότυπο:GBurl]] Catalysts for nitrogen fixation: nitrogenases, relevant chemical models and commercial processes] Check
|url=value (βοήθεια). Kluwer. ISBN 9781402036118. Unknown parameter|orig-date=ignored (βοήθεια) - ↑ Smil, V (1997). Cycles of Life. Scientific American Library. ISBN 9780716750796.
- ↑ Willey, Joanne M. (2011). Prescott's Microbiology (8th έκδοση). McGraw Hill. σελίδες 705. ISBN 978-0-07-337526-7.
- ↑ Sparacino-Watkins, Courtney; Stolz, John F.; Basu, Partha (2013-12-16). «Nitrate and periplasmic nitrate reductases». Chem. Soc. Rev. 43 (2): 676–706. doi:. PMID 24141308.
- ↑ Simon, Jörg; Klotz, Martin G. (2013). «Diversity and evolution of bioenergetic systems involved in microbial nitrogen compound transformations». Biochimica et Biophysica Acta (BBA) - Bioenergetics 1827 (2): 114–135. doi:. PMID 22842521.
- ↑ 28,0 28,1 28,2 Vitousek, PM; Aber, J; Howarth, RW; Likens, GE; Matson, PA; Schindler, DW; Schlesinger, WH; Tilman, GD (1997). «Human alteration of the global nitrogen cycle: Sources and consequences». Ecological Applications 1 (3): 1–17. doi:. ISSN 1051-0761. https://ecommons.cornell.edu/bitstream/1813/60830/1/Vitousek_et_al-1997-Ecological_Applications.pdf.
- ↑ Graf, Jon S.; Schorn, Sina; Kitzinger, Katharina; Ahmerkamp, Soeren; Woehle, Christian; Huettel, Bruno; Schubert, Carsten J.; Kuypers, Marcel M. M. και άλλοι. (3 March 2021). «Anaerobic endosymbiont generates energy for ciliate host by denitrification». Nature 591 (7850): 445–450. doi:. ISSN 0028-0836. PMID 33658719. Bibcode: 2021Natur.591..445G.
- ↑ Lam, Phyllis; Kuypers, Marcel M.M. (2011). «Microbial Nitrogen Processes in Oxygen Minimum Zones». Annual Review of Marine Science 3: 317–345. doi:. PMID 21329208. Bibcode: 2011ARMS....3..317L.
- ↑ Marchant, H.K.; Lavik, G.; Holtappels, M.; Kuypers, M.M.M. (2014). «The Fate of Nitrate in Intertidal Permeable Sediments». PLOS ONE 9 (8): e104517. doi:. PMID 25127459. Bibcode: 2014PLoSO...9j4517M.
- ↑ «Anammox». Anammox - MicrobeWiki. MicrobeWiki. Αρχειοθετήθηκε από το πρωτότυπο στις 27 Σεπτεμβρίου 2015. Ανακτήθηκε στις 5 Ιουλίου 2015.
- ↑ «Nitrogen Study Could 'Rock' A Plant's World». NPR.org. 2011-09-06. Αρχειοθετήθηκε από το πρωτότυπο στις 2011-12-05. https://web.archive.org/web/20111205114315/http://www.npr.org/2011/09/06/140206913/discovery-forces-scientists-to-rethink-nitrogen. Ανακτήθηκε στις 2011-10-22.
- ↑ Schuur, E. A. G. (2011). «Ecology: Nitrogen from the deep». Nature 477 (7362): 39–40. doi:. PMID 21886152. Bibcode: 2011Natur.477...39S.
- ↑ Morford, S. L.; Houlton, B. Z.; Dahlgren, R. A. (2011). «Increased forest ecosystem carbon and nitrogen storage from nitrogen rich bedrock». Nature 477 (7362): 78–81. doi:. PMID 21886160. Bibcode: 2011Natur.477...78M.
- ↑ Burgin, Amy J.; Yang, Wendy H.; Hamilton, Stephen K.; Silver, Whendee L. (2011). «Beyond carbon and nitrogen: how the microbial energy economy couples elemental cycles in diverse ecosystems». Frontiers in Ecology and the Environment 9 (1): 44–52. doi:. ISSN 1540-9309.
- ↑ Roman, J.; McCarthy, J.J. (2010). «The Whale Pump: Marine Mammals Enhance Primary Productivity in a Coastal Basin». PLOS ONE 5 (10): e13255. doi:. PMID 20949007. Bibcode: 2010PLoSO...513255R.
- ↑ Pajares Moreno, S.; Ramos, R. (2019). «Processes and Microorganisms Involved in the Marine Nitrogen Cycle: Knowledge and Gaps». Frontiers in Marine Science 6: 739. doi:.
 Material was copied from this source, which is available under a Creative Commons Attribution 4.0 International License.
Material was copied from this source, which is available under a Creative Commons Attribution 4.0 International License.
- ↑ 39,0 39,1 O'Brien, Paul A.; Morrow, Kathleen M.; Willis, Bette L.; Bourne, David G. (2016). «Implications of Ocean Acidification for Marine Microorganisms from the Free-Living to the Host-Associated». Frontiers in Marine Science 3. doi:.
 Material was copied from this source, which is available under a Creative Commons Attribution 4.0 International License.
Material was copied from this source, which is available under a Creative Commons Attribution 4.0 International License.
- ↑ Moulton, Orissa M; Altabet, Mark A; Beman, J Michael; Deegan, Linda A; Lloret, Javier; Lyons, Meaghan K; Nelson, James A; Pfister, Catherine A (May 2016). «Microbial associations with macrobiota in coastal ecosystems: patterns and implications for nitrogen cycling». Frontiers in Ecology and the Environment 14 (4): 200–8. doi:. ISSN 1540-9295.
- ↑ 41,0 41,1 Miller, Charles (2008). Biological Oceanography. Blackwell. σελίδες 60–62. ISBN 978-0-632-05536-4.
- ↑ 42,0 42,1 42,2 42,3 Gruber, Nicolas (2008). Nitrogen in the Marine Environment. Elsevier. σελίδες 1–35. ISBN 978-0-12-372522-6.
- ↑ Miller, Charles (2008). Biological oceanography. Blackwell. σελίδες 60–62. ISBN 978-0-632-05536-4.
- ↑ Boyes, Elliot, Susan, Michael. «Learning Unit: Nitrogen Cycle Marine Environment». Αρχειοθετήθηκε από το πρωτότυπο στις 15 Απριλίου 2012. Ανακτήθηκε στις 22 Οκτωβρίου 2011.
- ↑ 45,0 45,1 Lalli, Parsons, Carol, Timothy (1997). Biological oceanography: An introduction. Butterworth-Heinemann. ISBN 978-0-7506-3384-0.
- ↑ Holland, Elisabeth A.; Dentener, Frank J.; Braswell, Bobby H.; Sulzman, James M. (1999). «Contemporary and pre-industrial global reactive nitrogen budgets». Biogeochemistry 46 (1–3): 7. doi:.
- ↑ Gu, Baojing; Ge, Ying; Ren, Yuan; Xu, Bin; Luo, Weidong; Jiang, Hong; Gu, Binhe; Chang, Jie (2012-09-04). «Atmospheric Reactive Nitrogen in China: Sources, Recent Trends, and Damage Costs». Environmental Science & Technology 46 (17): 9420–7. doi:. ISSN 0013-936X. PMID 22852755. Bibcode: 2012EnST...46.9420G.
- ↑ Cosby, B. Jack; Cowling, Ellis B.; Howarth, Robert W.; Seitzinger, Sybil P.; Erisman, Jan Willem; Aber, John D.; Galloway, James N. (2003-04-01). «The Nitrogen Cascade». BioScience 53 (4): 341–356. doi:. ISSN 0006-3568. https://archive.org/details/sim_bioscience_2003-04_53_4/page/341.
- ↑ Chapin, S.F.· Matson, P.A.· Mooney, H.A. (2002). [[[:Πρότυπο:GBurl]] Principles of Terrestrial Ecosystem Ecology] Check
|url=value (βοήθεια). Springer. σελ. 345. ISBN 0-387-95443-0. - ↑ Proceedings of the Scientific Committee on Problems of the Environment (SCOPE) International Biofuels Project Rapid Assessment, 22–25 September 2008, Gummersbach, Germany, R. W. Howarth and S. Bringezu, editors. 2009 Executive Summary, p. 3 Αρχειοθετήθηκε 2009-06-06 στο Wayback Machine.
- ↑ Aerts, Rien; Berendse, Frank (1988). «The Effect of Increased Nutrient Availability on Vegetation Dynamics in Wet Heathlands». Vegetatio 76 (1/2): 63–69. doi:.
- ↑ Bobbink, R.; Hicks, K.; Galloway, J.; Spranger, T.; Alkemade, R.; Ashmore, M.; Bustamante, M.; Cinderby, S. και άλλοι. (2010-01-01). «Global assessment of nitrogen deposition effects on terrestrial plant diversity: a synthesis». Ecological Applications 20 (1): 30–59. doi:. ISSN 1939-5582. PMID 20349829. http://eprints.whiterose.ac.uk/10814/1/0Bobbinketal2010.pdf. Ανακτήθηκε στις 2019-09-30.
- ↑ Liu, Xuejun; Duan, Lei; Mo, Jiangming; Du, Enzai; Shen, Jianlin; Lu, Xiankai; Zhang, Ying; Zhou, Xiaobing και άλλοι. (2011). «Nitrogen deposition and its ecological impact in China: An overview». Environmental Pollution 159 (10): 2251–2264. doi:. PMID 20828899.
- ↑ Britto, Dev T.; Kronzucker, Herbert J. (2002). «NH4+ toxicity in higher plants: a critical review». Journal of Plant Physiology 159 (6): 567–584. doi:.
- ↑ Camargoa, Julio A.; Alonso, Álvaro (2006). «Ecological and toxicological effects of inorganic nitrogen pollution in aquatic ecosystems: A global assessment». Environment International 32 (6): 831–849. doi:. PMID 16781774. https://archive.org/details/sim_environment-international_2006-08_32_6/page/831.
- ↑ Rabalais, Nancy N.; Turner, R. Eugene; Wiseman, William J. Jr. (2002). «Gulf of Mexico Hypoxia, aka "The Dead Zone"». Annu. Rev. Ecol. Syst. 33: 235–63. doi:.
- ↑ Dybas, Cheryl Lyn. (2005). «Dead Zones Spreading in World Oceans». BioScience 55 (7): 552–557. doi:.
- ↑ New York State Environmental Conservation, Environmental Impacts of Acid Deposition: Lakes [1] Αρχειοθετήθηκε 2010-11-24 στο Wayback Machine.
- ↑ Power, J.F.; Schepers, J.S. (1989). «Nitrate contamination of groundwater in North America». Agriculture, Ecosystems & Environment 26 (3–4): 165–187. doi:. ISSN 0167-8809.
- ↑ Strebel, O.; Duynisveld, W.H.M.; Böttcher, J. (1989). «Nitrate pollution of groundwater in western Europe». Agriculture, Ecosystems & Environment 26 (3–4): 189–214. doi:. ISSN 0167-8809.
- ↑ Fewtrell, Lorna (2004). «Drinking-Water Nitrate, Methemoglobinemia, and Global Burden of Disease: A Discussion». Environmental Health Perspectives 112 (14): 1371–4. doi:. PMID 15471727. PMC 1247562. https://archive.org/details/sim_environmental-health-perspectives_2004-10_112_14/page/1371.
- ↑ Global Health Observatory : (GHO). World Health Organization. OCLC 50144984.
- ↑ Canter, Larry W. (2019-01-22), «Illustrations of Nitrate Pollution of Groundwater», Nitrates in Groundwater, Routledge, σελ. 39–71, doi:, ISBN 9780203745793
- ↑ Kampa, Marilena; Castanas, Elias (2008). «Human health effects of air pollution». Environmental Pollution 151 (2): 362–367. doi:. PMID 17646040. https://archive.org/details/sim_environmental-pollution_2008-01_151_2/page/362.
- ↑ Erisman, J. W.; Galloway, J. N.; Seitzinger, S.; Bleeker, A.; Dise, N. B.; Petrescu, A. M. R.; Leach, A. M.; de Vries, W. (2013-05-27). «Consequences of human modification of the global nitrogen cycle». Philosophical Transactions of the Royal Society B: Biological Sciences 368 (1621): 20130116. doi:. PMID 23713116.
|