Υδροχλωρικό οξύ
| Το λήμμα παραθέτει τις πηγές του αόριστα, χωρίς παραπομπές. |
| Υδροχλωρικό οξύ | |||
|---|---|---|---|
| |||

| |||
| |||
| Γενικά | |||
| Όνομα IUPAC | Υδροχλωρικό οξύ Υδρογόνο χλωρίδιο (το αέριο) | ||
| Άλλες ονομασίες | Σπίρτο του άλατος, κεζάπι | ||
| Χημικά αναγνωριστικά | |||
| Μοριακή μάζα | 36.46(g/mol) | ||
| Αριθμός CAS | 7647-01-0 | ||
| SMILES | Cl | ||
| InChI | 1/ClH/h1H | ||
| Αριθμός EINECS | 231-595-7 | ||
| Αριθμός RTECS | MW4025000 | ||
| PubChem CID | 313 | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | −27.32 °C (-17.18 °F) (245.83 K) (διάλυμα 38%) | ||
| Σημείο βρασμού | 110 °C (230 °F) (383.15 K) (διάλυμα 20.2%) 48 °C (118.4 °F) (321.15 K) (διάλυμα 38%) | ||
| Πυκνότητα | 1.18 g/mL (μεταβλητή) (τιμή για διάλυμα 36-38% w/w) | ||
| Διαλυτότητα στο νερό |
Το αέριο διαλυτό (700 g/L) | ||
| Ιξώδες | 1.9 cP (διάλυμα 31.5%) | ||
| Χημικές ιδιότητες | |||
| pKa | Μεταβλητή, -8.0 (για διάλυμα 37 % w/w) | ||
| Ελάχιστη θερμοκρασία ανάφλεξης |
Μη αναφλέξιμο | ||
| Επικινδυνότητα | |||
| Φράσεις κινδύνου | R34, R37 | ||
| Φράσεις ασφαλείας | S1/2, S26, S45 | ||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
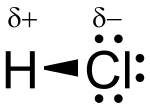
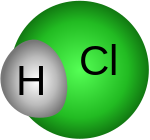
Το υδροχλωρικό οξύ είναι υδατικό διάλυμα του αέριου υδροχλωρίου με το οποίο έχει και τον ίδιο χημικό τύπο, HCl. Είναι ανόργανο ισχυρό οξύ, πολύ διαβρωτικό με πολλές και σημαντικές βιομηχανικές χρήσεις. Προσβάλλει το δέρμα και καταστρέφει κάθε φυτικό ή ζωικό ιστό. Η οσμή του είναι ερεθιστική και αποπνικτική. Το καθαρό υδροχλωρικό οξύ είναι τελείως άχρωμο, αλλά το υδροχλωρικό οξύ του εμπορίου είναι κιτρινωπό επειδή περιέχει προσμίξεις. Τα υγρά του στομάχου περιέχουν υδροχλωρικό οξύ που εκκρίνεται από πολυάριθμους μικρούς αδένες, οι οποίοι βρίσκονται στα τοιχώματά του.
Το παλιότερο όνομά του ήταν σπίρτο του άλατος. Το όνομα αυτό το πήρε από την εποχή κατά την οποία παρασκευαζόταν αποκλειστικά και μόνο από το κοινό μαγειρικό αλάτι το οποίο αποτελεί στη φύση άφθονη και φθηνή πρώτη ύλη. Πρώτος περιγράφει γενικά το οξύ ο Άραβας αλχημιστής Γιαμπίρ ιμπν Χαϊάν (Jabir ibn Hayyan) κατά τον 8ο αιώνα. Κατά τη διάρκεια του Μεσαίωνα χρησιμοποιήθηκε από τους αλχημιστές στην αναζήτηση της φιλοσοφικής λίθου[1], και αργότερα από Ευρωπαίους επιστήμονες όπως ο Γιόχαν Ρούντολφ Γκλάουμπερ (Johann Rudolf Glauber), ο Τζόζεφ Πρίστλεϋ (Joseph Priestley) και ο Σερ Χάμφρεϋ Ντέϊβυ (Humphry Davy).
Η παραγωγή του υδροχλωρικού οξέος σε μεγάλη κλίμακα αρχίζει κατά τη Βιομηχανική Επανάσταση και σήμερα χρησιμοποιείται ευρύτατα στη χημική βιομηχανία ως πρώτη ύλη στην παραγωγή πολυάριθμων εμπορικών προϊόντων. Χρησιμοποιείται όμως και σε πολλές άλλες περιπτώσεις όπως για τον καθαρισμό λεκανών των αφοδευτηρίων, για τον καθαρισμό των τοίχων από τις πολλές ασβεστώσεις, για τον καθαρισμό των μετάλλων πριν τον γαλβανισμό τους με ψευδάργυρος, για την παραγωγή ζελατίνης, στην επεξεργασία δέρματος κ.ά.
Από το 1988, το υδροχλωρικό οξύ έχει καταγραφεί στη Σύμβαση των Ηνωμένων Εθνών κατά της παράνομης διακίνησης ναρκωτικών φαρμάκων και ψυχοτρόπων ουσιών ως πρόδρομη ένωση για την παραγωγή της ηρωίνης, της κοκαΐνης και της μεθαμφεταμίνης.
Ιστορία[Επεξεργασία | επεξεργασία κώδικα]

Το υδροχλωρικό οξύ ανακαλύφθηκε για πρώτη φορά γύρω στο 800 μ.Χ. από τον αλχημιστή Γιαμπίρ ιμπν Χαϊάν ο οποίος ανακάτεψε μαγειρικό αλάτι (χλωριούχο νάτριο) με βιτριόλι (θειικό οξύ). Ο Γιαμπίρ ανακάλυψε πολλές σπουδαίες χημικές ενώσεις και κατέγραψε τις ανακαλύψεις τους σε περισσότερα από είκοσι βιβλία. Έτσι, η γνώση για το υδροχλωρικό οξύ και τα άλλα αντιδραστήρια διατηρήθηκε για εκατοντάδες χρόνια. Η ανακάλυψη από το Γιαμπίρ του βασιλικού νερού που αποτελείται από υδροχλωρικό και νιτρικό οξύ, ενδιέφερε πάρα πολύ τους αλχημιστές που έψαχναν για τη φιλοσοφική λίθο.
Κατά τον Μεσαίωνα, το υδροχλωρικό οξύ ήταν γνωστό στους Ευρωπαίους αλχημιστές ως σπίρτο του άλατος. Το αέριο HCl ονομαζόταν θαλασσινό οξύ του αέρα. Αξιοσημείωτη παραγωγή υδροχλωρικού οξέος καταγράφηκε από τον Βασίλειο Βαλεντίνο (Basilius Valentinus), αλχημιστή του μοναστηριού των Βενεδικτίνων Σανκτ Πέτερ (Sankt Peter) στην Ερφούρτη της Γερμανίας, κατά το 15ο αιώνα. Τον 17ο αιώνα, ο Γκλάουμπερ από το Κάρλστατ (Karlstadt) της Γερμανίας, χρησιμοποίησε χλωριούχο νάτριο και θειικό οξύ για την παρασκευή του θειικού νατρίου, απελευθερώνοντας αέριο υδροχλώριο. Το 1772 ο Άγγλος χημικός Πρίστλεϋ από το Ληντς (Leeds) παρασκεύασε καθαρό υδροχλώριο και το 1818 ο επίσης Άγγλος χημικός Ντέϊβυ από το Πένζενς (Penzance) απέδειξε ότι το υδροχλώριο αποτελείται από υδρογόνο και χλώριο.
Κατά τη διάρκεια της βιομηχανικής επανάστασης στην Ευρώπη, η ζήτηση για αλκαλικές ουσίες αυξήθηκε. Μία νέα βιομηχανική διαδικασία του Γάλλου Νικολά Λεμπλάν (Nicolas Leblanc) επέτρεψε τη φθηνή και σε μεγάλη κλίμακα παραγωγή του ανθρακικού νατρίου (σόδας). Στη μέθοδο Leblanc, το κοινό αλάτι μαζί με θειικό οξύ, ασβεστόλιθο και άνθρακα, μετατρεπόταν σε ανθρακικό νάτριο απελευθερώνοντας υδροχλώριο στην ατμόσφαιρα ως παραπροϊόν. Το 1863 θεσπίστηκε νόμος στην Αγγλία και σε άλλες χώρες που υποχρέωνε τους παραγωγούς σόδας να μην ελευθερώνουν το υδροχλώριο στον αέρα αλλά να το διοχετεύουν στο νερό. Έτσι ξεκίνησε η παραγωγή υδροχλωρικό οξύ σε βιομηχανική κλίμακα.
Τον 20ό αιώνα, η μέθοδος Leblanc αντικαταστάθηκε από τη μέθοδο Σολβέ (Solvay) κατά την οποία δεν παράγεται υδροχλωρικό οξύ ως παραπροϊόν. Επειδή όμως το υδροχλωρικό οξύ είχε ήδη αποκτήσει μεγάλο ενδιαφέρον ως χημικό προϊόν, επινοήθηκαν άλλες μέθοδοι παραγωγής του, μερικές από τις οποίες εξακολουθούν να χρησιμοποιούνται και σήμερα. Μετά το 2000, το υδροχλωρικό οξύ, παράγεται κυρίως από τη διοχέτευση σε νερό του του παραπροϊόντος υδροχλωρίου από τη βιομηχανική παραγωγή οργανικών ενώσεων.
Προέλευση[Επεξεργασία | επεξεργασία κώδικα]
Το αέριο υδροχλώριο βρίσκεται στη φύση σε μικρά ποσά στα αέρια των ηφαιστείων. Το υδατικό διάλυμα υπάρχει στο γαστρικό υγρό των θηλαστικών. Τα άλατά του (π.χ. NaCl) είναι πολύ διαδεδομένα στη φύση κυρίως στο θαλασσινό νερό αλλά και σαν ορυκτά (Αλίτης, συλβίνης, καρναλίτης κ.ά)
Παρασκευές[Επεξεργασία | επεξεργασία κώδικα]
Παρασκευές αέριου υδροχλωρίου[Επεξεργασία | επεξεργασία κώδικα]
Το αέριο υδροχλώριο παράγεται εργαστηριακά:
- Με θέρμανση στους 150 °C του χλωριούχου νατρίου με περίσσεια πυκνού θειικού οξέος.
- Με υδρόλυση τριχλωριούχου φωσφόρου.
- Συνθετικά από τα στοιχεία του.
- Ως παραπροϊόν της χλωρίωσης των αλκανίων και της φθορίωσης των αλκυλοχλωριδίων.
Βιομηχανικά παράγεται με θέρμανση στους 350 °C του χλωριούχου νατρίου με πυκνό θειικό οξύ.
Βιομηχανική παραγωγή υδροχλωρικού οξέος[Επεξεργασία | επεξεργασία κώδικα]
Το υδροχλωρικό οξύ παρασκευάζεται με διάλυση του αέριου υδροχλωρίου σε νερό. Μεγάλης κλίμακας παραγωγή υδροχλωρικού οξέος γίνεται συνήθως σε συμπαραγωγή με άλλα χημικά προϊόντα.
Το υδροχλωρικό οξύ παράγεται σε διαλύματα μέχρι και 38 % σε HCl. Παραγωγή διαλυμάτων μεγαλύτερων συγκεντρώσεων (μέχρι λίγο πάνω από το 40 %) είναι εφικτή από χημικής άποψης, αλλά ο ρυθμός εξάτμισης είναι τόσο υψηλός που η αποθήκευση και ο χειρισμός του οξέος χρειάζονται επιπλέον προφυλάξεις, όπως εφαρμογή πίεσης και χαμηλής θερμοκρασίας. Μαζική βιομηχανική παραγωγή γίνεται για συγκεντρώσεις 30% έως 34% έτσι ώστε να είναι εύκολη η μεταφορά του οξέος και ο περιορισμός απωλειών από τους ατμούς του αέριου HCl. Διαλύματα για οικιακή καθαριστική χρήση είναι περιεκτικότητας 14 % - 16 %.
Οι κυριότερες βιομηχανίες παραγωγής υδροχλωρικού οξέος σε παγκόσμιο επίπεδο είναι η Dow Chemical και η Georgia Gulf Corporation των Η.Π.Α., η Κινέζικη FMC, η Tosoh Corporation από την Ιαπωνία, η Ολλανδική Akzo Nobel και η Βελγική Tessenderlo. Η συνολική παγκόσμια παραγωγή, εκφρασμένη ως HCl, εκτιμάται σε 20 εκατομμύρια τόνους/έτος από τους οποίους τα 3 εκατομμύρια προέρχονται από άμεση σύνθεση και το υπόλοιπο από δευτερογενείς διεργασίες.
Φυσικά χαρακτηριστικά[Επεξεργασία | επεξεργασία κώδικα]
Γενικά τα διαλύματα του υδροχλωρικού οξέος είναι διαυγή, άχρωμα και σε υψηλές συγκεντρώσεις ατμίζοντα. Οι φυσικές ιδιότητές τους όπως σημείο βρασμού και σημείο τήξης, πυκνότητα, pH κλπ. εξαρτώνται από τη συγκέντρωση του διαλύματος. Ο παρακάτω πίνακας δείχνει τα φυσικά χαρακτηριστικά κάποιων διαλυμάτων υδροχλωρικού οξέος.
| Περιεκτικότητα | Πυκνότητα | Molarity | pH | Ιξώδες | Ειδική θερμότητα |
Τάση ατμών |
Σημείο βρασμού |
Σημείο τήξης | |
|---|---|---|---|---|---|---|---|---|---|
| % w/w[2] | % w/v[2] | g/mL | mol/L | mPa·s | kJ/(kg·K) | Pa | °C | °C | |
| 10% | 10.48 | 1.048 | 2.87 | −0.5 | 1.16 | 3.47 | 0.527 | 103 | −18 |
| 20% | 21.96 | 1.098 | 6.02 | −0.8 | 1.37 | 2.99 | 27.3 | 108 | −59 |
| 30% | 34.47 | 1.149 | 9.45 | −1.0 | 1.70 | 2.60 | 1,410 | 90 | −52 |
| 32% | 37.09 | 1.159 | 10.17 | −1.0 | 1.80 | 2.55 | 3,130 | 84 | −43 |
| 34% | 39.75 | 1.169 | 10.90 | −1.0 | 1.90 | 2.50 | 6,733 | 71 | −36 |
| 36% | 42.44 | 1.179 | 11.64 | −1.1 | 1.99 | 2.46 | 14,100 | 61 | −30 |
| 38% | 45.18 | 1.189 | 12.39 | −1.1 | 2.10 | 2.43 | 28,000 | 48 | −26 |
Χημικές ιδιότητες[Επεξεργασία | επεξεργασία κώδικα]
Αζεοτροπικό μίγμα[Επεξεργασία | επεξεργασία κώδικα]
Το υδροχλωρικό οξύ σχηματίζει με το νερό δυαδικό (δηλ. δύο συστατικών) αζεοτροπικό μίγμα[3] που αποστάζει με αναλογία 20.22 % w/w σε HCl στους 108.58 °C. Έτσι, αν βράσουμε σε πίεση 1 Atm μίγμα HCl-H2Ο οποιασδήποτε σύστασης, θα μείνει στη φιάλη βρασμού διάλυμα 20.22 % w/w σε HCl. Το διάλυμα αυτό θα αποστάζει στους 108.58 °C, χωρίς μεταβολή στη σύσταση και στο σημείο βρασμού του. Από διάλυμα, λοιπόν, περιεκτικότητας > 20.22 % μπορεί να αποχωριστεί με απόσταξη καθαρό HCl, ενώ από διαλύματα μικρότερης περιεκτικότητας θα αποχωριστεί καθαρό νερό. Επειδή το αζεοτροπικό αυτό σύστημα HCl-H2Ο έχει σταθερό σημείο βρασμού και σύσταση, χρησιμοποιείται ως πρότυπο διάλυμα για την παρασκευή διαλυμάτων διαφόρων συγκεντρώσεων απαραίτητων στην ογκομετρική ανάλυση, παρόλο που η ακριβής συγκέντρωση του διαλύματος εξαρτάται από την ατμοσφαιρική πίεση κατά τη στιγμή της παρασκευής του διαλύματος.
Υπάρχουν τέσσερα σταθερά ευτηκτικά σημεία για το υδροχλωρικό οξύ μεταξύ του πάγου (που είναι 0 % σε HCl) και ισάριθμων κρυσταλλικών μορφών : HCl·H2Ο (68% HCl), HCl·2H2Ο (51% HCl), HCl·3H2Ο (41% HCl) και HCl·6H2Ο (25% HCl).
Το υδροχλωρικό ως ισχυρό οξύ[Επεξεργασία | επεξεργασία κώδικα]
Το υδροχλωρικό είναι μονοπρωτικό οξύ, πράγμα που σημαίνει ότι ιοντίζεται πλήρως σε ένα στάδιο αποδίδοντας ένα πρωτόνιο το οποίο βέβαια είναι εφυδατωμένο (Η3Ο+) και ένα ανιόν χλωρίου (Cl-) :
- HCl + H2Ο → H3O+ + Cl−
Το υδροχλωρικό οξύ μπορεί επομένως να χρησιμοποιηθεί για την παρασκευή χλωριούχων αλάτων όπως είναι το χλωριούχο νάτριο (ΝaCl).
Τα μονοπρωτικά οξέα έχουν μιά σταθερά ιοντισμού, Ka, η οποία εκφράζει και το ποσοστό ιοντισμού ή διάστασης της χημικής ένωσης στο νερό. Για ένα ισχυρό οξύ όπως το υδροχλωρικό, η Ka είναι μεγάλη [4] και εξαρτάται από την περιεκτικότητα του διαλύματος σε HCl. Δεν είναι γενικά καλώς ορισμένη και αναφέρονται τιμές όπως 103 και 104 ακόμα και 107 που δεν στηρίζονται όμως σε θερμοδυναμικά δεδομένα.
Όταν χλωριούχα άλατα, όπως το NaCl, προσθέτονται σε υδατικά HCl, ουσιαστικά δεν επηρεάζουν το pH αποδεικνύοντας ότι το ανιόν Cl- είναι ασθενής συζυγής βάση και δεν υδρολύεται. Για διαλύματα υδροχλωρικού οξέος ενδιάμεσης ισχύος, η ταύτιση της Molarity του οξέος και της Molarity των ιόντων Η3Ο+ στο διάλυμα είναι πολύ ικανοποιητική (μέχρι τέσσερα δεκαδικά ψηφία) πράγμα που επιβεβαιώνει τον ισχυρό χαρακτήρα και τον πλήρη ιοντισμό του οξέος.
Από τα ισχυρά οξέα, το υδροχλωρικό είναι το μονοπρωτικό οξύ που έχει τις λιγότερες πιθανότητες να αλλοιωθεί κατά την αποθήκευση ή τον χειρισμό του. Τα διαλύματά του είναι αρκετά σταθερά και το ανιόν χλωρίου που περιέχουν είναι σχετικά αδρανές και μη-τοξικό.
Το υδροχλωρικό οξύ αποτελεί άριστο μέσο οξίνισης και προτιμάται έναντι άλλων οξέων στις ογκομετρήσεις προσδιορισμού της ποσότητας μιας βάσης που περιέχεται σε ένα υδατικό διάλυμα. Άλλωστε τα ισχυρά οξέα έχουν μεγαλύτερη ακρίβεια στον καθορισμό του τελικού σημείου μιας ογκομετρήσεις.
Αντιδράσεις υδροχλωρικού οξέος[Επεξεργασία | επεξεργασία κώδικα]
♦ Αντιδράσεις οξέος-βάσης
Αντιδρά με υδατικά διαλύματα βάσεων (π.χ. διάλυμα υδροξειδίου του νατρίου, NaOH, διάλυμα αμμωνίας ΝΗ3 κλπ.) και βασικών οξειδίων (π.χ. οξείδιο του ασβεστίου, CaO κ.ά.):
- NaOH + HCl → NaCl + H2O
- HCl + NH3 → NH4Cl[5]
- CaO + 2HCl → CaCl2 + H2O
♦ Μεταθετικές αντιδράσεις
Αντιδρά με άλατα ασθενών οξέων όπως π.χ. το θειώδες νάτριο, Na2SO3 (άλας του θειώδους οξέος), ανθρακικό ασβέστιο, CaCO3 (άλας του ανθρακικού οξέος) κλπ. :
- Na2SO3 + 2HCl → 2NaCl + H2Ο + SO2↗
- CaCO3 + 2HCl → CaCl2 + H2Ο + CO2↗
♦ Δράση ως οξειδωτικό
Δίνει αντιδράσεις απλής αντικατάστασης με μέταλλα που οφείλονται στην οξειδωτική δράση του υδροξωνίου (Η3Ο+). Το υδροχλωρικό οξύ αντιδρά με τα μέταλλα πάνω από το Η2 στην ηλεκτροχημική σειρά των μετάλλων οπότε εκλύεται Η2 και σχηματίζεται χλωρίδιο του μετάλλου που περιέχει το μέταλλο με τον κατώτερο αριθμό οξείδωσής του :
- M + xHCl → MClx + ½ H2↗
όπου x = ο μικρότερος αριθμός οξείδωσης του μετάλλου και Μ = όλα τα μέταλλα εκτός Bi, Cu, Hg, Ag, Pt, Au π.χ.
- 2HCl + Fe → FeCl2 + H2↗
♦ Δράση ως αναγωγικό
Οξειδώνεται από τα πιο ισχυρά από το χλώριο οξειδωτικά στοιχεία όπως το φθόριο (F2) και το όζον (O3). Το χλώριο αντικαθίσταται από F και Ο αντίστοιχα :
- F2 + 2HCl → 2HF + Cl2
- O3 + 2HCl → Cl2 + O2 + H2O
Οξειδώνεται από ισχυρά οξειδωτικά όπως το υπερμαγγανικό κάλιο (KMnO4), το διχρωμικό κάλιο (K2Cr2O7), το νιτρικό οξύ (HNO3) και τα οξείδια του μαγγανίου (MnO2) και του μολύβδου (PbO2) :
- 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
- K2Cr2O7 + 14HCl → 2KCl + 2CrCl3 + 3Cl2 + 7H2O
- 2HNO3 + 6HCl → 2NO + 4H2Ο + 3Cl2
- MO2 + 4HCl → MCl2 + Cl2 + H2Ο όπου Μ = Mn, Pb
Αντιδρά επίσης με το υπεροξείδιο του νατρίου :
- Na2O2 + 4HCl → 2NaCl + Cl2 + 2H2O
με υπερχλωρικό κάλιο :
- KClO3 + 6HCl → KCl + 3Cl2 + 3H2O
με χλωράσβεστο :
- CaOCl2 + 2HCl → CaCl2 + Cl2 + H2O
με νιτρικό νάτριο :
- 2NaNO3 + 10HCl → 2NaCl + N2Ο + 2Cl2 + 5H2O
♦ Το βασιλικό ύδωρ
Το βασιλικό ύδωρ είναι μίγμα αραιού νιτρικού (HNO3) και υδροχλωρικού οξέος, τα οποία αντιδρούν με αναλογία 1:3. Ονομάστηκε έτσι γιατί διαλύει τον βασιλιά των μετάλλων, τον χρυσό (Au) και τον μετατρέπει σε χλωριούχο χρυσό(III) (AuCl3) που είναι ευδιάλυτος στο νερό :
- HNO3 + 3HCl + Au → AuCl3 + NO↗ + 2H2O
♦ Ανίχνευση του υδροχλωρικού οξέος
Το υδροχλωρικό οξύ και τα άλατά του ανιχνεύονται με την προσθήκη διαλύματος νιτρικού αργύρου (AgNO3), οπότε σχηματίζεται χαρακτηριστικό άσπρο ίζημα σύμφωνα με την αντίδραση:
- Ag+ + Cl- → AgCl↘
Το αέριο HCl ανιχνεύεται με αέρια αμμωνία (ΝΗ3) οπότε σχηματίζονται λευκά νέφη χλωριούχου αμμωνίου (NH4Cl).
Χρήσεις[Επεξεργασία | επεξεργασία κώδικα]
Διαλύτης[Επεξεργασία | επεξεργασία κώδικα]

Το υδροχλωρικό οξύ χρησιμοποιείται πολύ στην αναλυτική χημεία και αποτελεί τον κυριότερο μέσο διάλυσης δειγμάτων ορυκτών και κραμάτων. Τα κύρια πλεονεκτήματά του είναι :
- Η πολύ ασθενής αναγωγική του δράση.
- Η εύκολη απομάκρυνση της περίσσειας του.
- Το γεγονός ότι τα περισσότερα χλωριούχα άλατα των διαφόρων μετάλλων είναι υδατοδιαλυτά.
Το υδροχλωρικό οξύ διαλύει τα περισσότερα από τα κοινά μέταλλα. Εξαιρούνται τα : αντιμόνιο (Sb), άργυρος (Ag), αρσενικό (As), βισμούθιο (Bi), υδράργυρος (Hg) και χαλκός (Cu). Οι αντιδράσεις διάλυσης του μολύβδου (Pb), του κοβαλτίου (Co), του νικελίου (Ni) και του καδμίου (Cd) είναι πολύ αργές.
Τα περισσότερα από τα οξείδια και υδροξείδια των κοινών μετάλλων είναι επίσης διαλυτά στο υδροχλωρικό οξύ. Προσβάλλονται επίσης και τα ανθρακικά άλατα όπως ο ασβεστόλιθος αλλά και τα θειούχα ορυκτά όπως ο γαληνίτης και ο αντιμονίτης. Εξαιρείται ο σιδηροπυρίτης.
Τρόφιμα[Επεξεργασία | επεξεργασία κώδικα]
Πολλές χημικές αντιδράσεις που εμπλέκουν το υδροχλωρικό οξύ εφαρμόζονται στην παραγωγή τροφίμων, συστατικών τροφίμων και πρόσθετων. Τα τρόφιμα στα οποία χρησιμοποιείται το οξύ είναι η ασπαρτάμη, η φρουκτόζη, το κιτρικό οξύ, η λυσίνη, διάφορες υδρολυόμενες φυτικές πρωτεΐνες κ.ά. Χρησιμοποιείται επίσης ως ρυθμιστής οξύτητας (E507) στα τυροκομικά και στην μπύρα χωρίς να έχουν αναφερθεί παρενέργειες.
Καθαρισμός του χάλυβα[Επεξεργασία | επεξεργασία κώδικα]
Μια από τις σημαντικότερες εφαρμογές του υδροχλωρικού οξέος είναι η απομάκρυνση της σκουριάς και των ανεπιθύμητων προσμίξεων από την επιφάνεια χάλυβα αυξημένης περιεκτικότητας σε άνθρακα, πριν από κάποια επεξεργασία όπως η ανόπτυση, ο γαλβανισμός κλπ. Χρησιμοποιείται κατά κανόνα διάλυμα 18%. Η αντίδραση αφαίρεσης του οξειδίου του σιδήρου είναι :
- Fe2O3 + Fe + 6HCl → 3FeCl2 + 3H2O
Το προϊόν δηλ. ο χλωριούχος σίδηρος(ΙΙ), FeCl2, επαναχρησιμοποιείται αντί για το υδροχλωρικό οξύ έχοντας τα ίδια αποτελέσματα αλλά τελικά δηλητηριάζεται από την παρουσία βαρέων μετάλλων στον χάλυβα.
Παράλληλα με τις βιομηχανικές τεχνικές καθαρισμού του χάλυβα, έχουν αναπτυχθεί και διεργασίες επανάκτησης του υδροχλωρικού οξέος όπως η τεχνική ρευστοποιημένης κλίνης, με τις οποίες αναδημιουργείται το οξύ από τα απόβλητα των καθαρισμών. Η πιο συνηθισμένη τεχνική είναι η υδροπυρόλυση που βασίζεται στην αντίδραση :
- 4FeCl2 + 4H2Ο + O2 → 2Fe2O3 + 8HCl
Παραγωγή οργανικών ενώσεων[Επεξεργασία | επεξεργασία κώδικα]
Το υδροχλωρικό οξύ χρησιμοποιείται για την παραγωγή οργανικών ενώσεων όπως το βινυλο-χλωρίδιο (χλωρο-αιθάνιο, CH2=CHCl), ο πολυμερισμός του οποίου οδηγεί στο πολυ-βινυλο-χλωρίδιο, το γνωστό PVC. Το βινυλο-χλωρίδιο παράγεται από την καταλυτική αντίδραση του υδροχλωρικού οξέος με το ακετυλένιο :
- C2H2 + HCl → CH2=CHCl
Άλλες οργανικές ενώσεις που παράγονται με υδροχλωρικό οξύ είναι η διφαινόλη Α (που χρησιμοποιείται στην παραγωγή πολυανθρακικών θερμοπλαστικών πολυμερών), ο ενεργός άνθρακας, το ασκορβικό οξύ (βιταμίνη C) και πολλά φαρμακευτικά προϊόντα.
Παραγωγή ανόργανων ενώσεων[Επεξεργασία | επεξεργασία κώδικα]
Πολυάριθμες ανόργανες ενώσεις μπορούν να παραχθούν από το υδροχλωρικό οξύ με αντιδράσεις οξέος-βάσης. Μεταξύ αυτών περιλαμβάνονται χημικά προϊόντα επεξεργασίας νερού όπως ο χλωριούχος σίδηρος (ΙΙΙ) που παράγεται από τον μαγνητίτη (Fe2O3) με την αντίδραση :
- Fe2O3 + 6HCl → 2FeCl3 + 3H2O
αλλά και ένυδρα χλωριούχα άλατα του αργιλίου[6] (PAC).
Άλλες ανόργανες ενώσεις που παράγονται με υδροχλωρικό οξύ είναι διάφορα χλωριούχα άλατα όπως χλωριούχο ασβέστιο (CaCl2) και χλωριούχο νικέλιο (NiCl2) που χρησιμοποιούνται στην ηλεκτρολυτική επιμετάλλωση :
- CaCO3 + 2HCl → CaCl2 + CO2 + H2Ο
καθώς και ο χλωριούχος ψευδάργυρος (ZnCl2) που χρησιμοποιείται στους γαλβανισμούς και στη βιομηχανία παραγωγής μπαταριών.
Έλεγχος του pH και εξουδετέρωση[Επεξεργασία | επεξεργασία κώδικα]
Το υδροχλωρικό οξύ μπορεί να χρησιμοποιηθεί στη ρύθμιση του pH ενός διαλύματος αφού αντιδρά με τα ιόντα υδροξυλίου (ΟΗ-) :
- OH− + HCl → H2Ο + Cl−
Σε βιομηχανίες τροφίμων και φαρμάκων όπου απαιτείται υψηλή καθαρότητα των προϊόντων, το υδροχλωρικό οξύ που χρησιμοποιείται για έλεγχο του pH πρέπει να είναι εξαιρετικής ποιότητας. Σε άλλες περιπτώσεις όπως π.χ. στην εξουδετέρωση υγρών αποβλήτων, επαρκεί η καθαρότητα του εμπορικού υδροχλωρικού οξέος.
Αναγέννηση ιοντοανταλλακτών[Επεξεργασία | επεξεργασία κώδικα]
Πολύ καλής ποιότητας υδροχλωρικό οξύ χρησιμοποιείται στην αναγέννηση των ρητινών ανταλλαγής ιόντων (ιοντοανταλλακτικές ρητίνες). Η ανταλλαγή κατιόντων χρησιμοποιείται ευρέως για την αφαίρεση ιόντων, όπως π.χ. Na+ και Ca2+ από το νερό για παραγωγή απιονισμένου νερού. Το οξύ χρησιμοποιείται για την έκπλυση των κατιόντων από τις ρητίνες.
- Ιόντα Na+ αντικαθίστανται από H+
- Ιόντα Ca2+ αντικαθίστανται από 2H+
Οι ιοντοανταλλάκτες και το απιονισμένο νερό χρησιμοποιούνται σε όλες τις βιομηχανίες χημικών προϊόντων, παραγωγης πόσιμου νερού, και σε όλες τις βιομηχανίες τροφίμων.
Άλλες χρήσεις[Επεξεργασία | επεξεργασία κώδικα]
Το υδροχλωρικό οξύ χρησιμοποιείται σε μεγάλο αριθμό εφαρμογών μικρής κλίμακας όπως η επεξεργασία δερμάτων, ο οικιακός καθαρισμός και η κατασκευή κτιρίων. Χρησιμοποιείται επίσης στην παρασκευή φωσφορικού οξέος, χλωριούχου αμμωνίου, λιπασμάτων, χρωμάτων και τεχνητού μεταξιού και ακόμα για τον καθαρισμό μεμβρανών σε μονάδες αφαλάτωσης, για την παραγωγή συνθετικού καουτσούκ από την επεξεργασία ισοπρένιου. Οι διαδικασίες άντλησης πετρελαίου μπορούν να βελτιωθούν με εγχύσεις υδροχλωρικού οξέος στα πετρώματα που περιβάλλουν τα πετρελαϊκά κοιτάσματα. Έτσι διαλύεται ένα μέρος των βράχων και μεγαλώνει η δομή του κοιτάσματος.
Το υδροχλωρικό οξύ στους ζωικούς οργανισμούς[Επεξεργασία | επεξεργασία κώδικα]
Το γαστρικό υγρό αποτελεί μια από τις κυριότερες εκκρίσεις των κυττάρων των τοιχωμάτων του στομάχου των θηλαστικών. Στον άνθρωπο αποτελείται κυρίως από υδροχλωρικό οξύ (περίπου 5000 ppm) και από χλωριούχο κάλιο και νάτριο. Το pH του γαστρικού υγρού είναι από 1 έως 2.
Το γαστρικό υγρό ενεργεί ως φραγμός έναντι μικροοργανισμών για την πρόληψη των λοιμώξεων και παίζει σημαντικό ρόλο στην πέψη των τροφών. Το χαμηλό pH του μετουσιώνει τις πρωτεΐνες των τροφών και έτσι διευκολύνει την πέψη τους από πεπτικά ένζυμα όπως η πεψίνη. Μετά την απομάκρυνση από το στομάχι, το υδροχλωρικό οξύ εξουδετερώνεται στον δωδεκαδάκτυλο από όξινο ανθρακικό νάτριο.
Το ίδιο το στομάχι προστατεύεται από το ισχυρό οξύ εκκρίνοντας ένα παχύ, προστατευτικό στρώμα βλέννας που αποτελείται από ρυθμιστικό διάλυμα σεκρετίνης-όξινου ανθρακικού νατρίου. Αν οι παραπάνω μηχανισμοί δε λειτουργούν σωστά, προκαλούνται πεπτικά έλκη και καούρες.
Ασφάλεια[Επεξεργασία | επεξεργασία κώδικα]
| Σήμανση επικίνδυνων υλικών |
|---|
 
|
Το πυκνό υδροχλωρικό οξύ είναι ατμίζον. Τόσο οι ατμοί όσο και το διάλυμα έχουν διαβρωτική επίδραση στους ανθρώπινους ιστούς και προσβάλλουν το αναπνευστικό σύστημα, τα μάτια, το δέρμα και τα έντερα. Μετά την ανάμειξη του υδροχλωρικού οξέος με κοινά χημικά οξειδωτικά, όπως το υποχλωριώδες νάτριο (χλωρίνη, NaClO) ή το υπερμαγγανικό κάλιο (KMnO4), παράγεται τοξικό αέριο χλώριο :
- NaClO + 2HCl → NaCl + Cl2↗ + H2O
- 2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2↗ + 8H2O
Οι εξοπλισμοί ατομικής προστασίας πρέπει να περιλαμβάνουν γάντια από λάστιχο ή από PVC, προστατευτικά γυαλιά και ρούχα ανθεκτικά στα οξέα. Οι κίνδυνοι από τα διαλύματα υδροχλωρικού οξέος εξαρτώνται από τη συγκέντρωση. Ο ακόλουθος πίνακας παραθέτει την ταξινόμηση της Ευρωπαϊκής Ένωσης για τα διαλύματα του υδροχλωρικού οξέος :
| Περιεκτικότητα % w/w |
Ταξινόμηση | Φράσεις κινδύνου |
|---|---|---|
10 - 25%
|
Ερεθιστικό (Xi) | 36/37/38
|
> 25%
|
Διαβρωτικό (C) | 34, 37
|
Σημειώσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Η Φιλοσοφική Λίθος ήταν ένα θρυλικό εργαλείο που έψαχναν οι αλχημιστές, γιατί πίστευαν ήταν το ελιξήριο της Ζωής και ότι μ' αυτό μπορούσαν να μετατρέψουν τα μέταλλα σε χρυσό.
- ↑ 2,0 2,1 Οι μονάδες μέτρησης με πλάγια γράμματα δεν είναι του SI, συνηθίζονται όμως περισσότερο στη Χημεία.
% w/w = Τα g HCl σε 100 g υδατικού διαλύματος.
% w/v = Τα g HCl σε 100 mL υδατικού διαλύματος - ↑ Μίγμα δύο ή περισσότερων υγρών χημικών ενώσεων σε τέτοια αναλογία που η σύνθεσή του δεν μπορεί να τροποποιηθεί άλλο με απλή απόσταξη
- ↑ Αντίστοιχα το pKa = -logKa είναι μικρό. Όταν π.χ. Ka = 103, τότε pKa = -3
- ↑ Το αέριο HCl αντιδρά με την αμμωνία και στην αέρια φάση σχηματίζοντας λευκά νέφη χλωριούχου αμμωνίου
- ↑ Ομάδα αλάτων της γενικής μορφής AlnCl(3n-m)(OH)m. Χρησιμοποιούνται ως αποσμητικά, αντιιδρωτικά και κροκιδωτικά στην κατεργασία υγρών αποβλήτων
Πηγές[Επεξεργασία | επεξεργασία κώδικα]
- Βασιλικιώτης Γ. Σ. "Ποιοτική Ανάλυση", Θεσσαλονίκη 1980.
- Βασιλικιώτης Γ. Σ. "Ποσοτική Ανάλυση", Θεσσαλονίκη 1980.
- Μανουσάκης Γ.Ε. "Γενική και Ανόργανη Χημεία", Τόμοι 1ος και 2ος, Θεσσαλονίκη 1981.
- Μανωλκίδης Κ., Μπέζας Κ. "Στοιχεία Ανόργανης Χημείας", Έκδοση 14η, Αθήνα 1984.
- Μανωλκίδης Κ., Μπέζας Κ. "Χημικές Αντιδράσεις", Αθήνα 1976.
- Βασιλικιώτης Γ. Σ. "Χημεία Περιβάλλοντος", Θεσσαλονίκη 1986.
- Μπόσκου Δ. "Χημεία τροφίμων με Στοιχεία Τεχνολογίας Τροφίμων", Θεσσαλονίκη 1986.
- Βασάλος Ι. Α. "Τεχνολογία Πετρελαίου", Θεσσαλονίκη 1988.
- Βασάλος Ι. Α. "Πετροχημική Τεχνολογία", Θεσσαλονίκη 1988.
- Μπαζάκης Ι. Α. "Γενική Χημεία", Αθήνα.
Δείτε επίσης[Επεξεργασία | επεξεργασία κώδικα]
Εξωτερικοί σύνδεσμοι[Επεξεργασία | επεξεργασία κώδικα]
- Πίνακας πυκνοτήτων διαφόρων διαλυμάτων υδροχλωρικού οξέος
- Υπηρεσία Περιβαλλοντικής Προστασίας των Η.Π.Α.
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
|

