Σαλικυλαλδεΰδη
| Σαλικυλαλδεΰδη | |||
|---|---|---|---|

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | 2-υδροξυβενζαλδεΰδη | ||
| Άλλες ονομασίες | Σαλικυλαλδεΰδη Σαλικυλική αλδεΰδη 2-υδροξυφαινυλομεθανάλη | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C7H6O | ||
| Μοριακή μάζα | 106,12 amu | ||
| Σύντομος συντακτικός τύπος |
(C6H4)(2-OH)CHO | ||
| Αριθμός CAS | 90-02-8 | ||
| SMILES | O=Cc1ccccc1O | ||
| InChI | 1S/C7H6O2/c8-5-6-3-1-2-4-7(6)9/h1-5,9H | ||
| ChemSpider ID | 13863618 | ||
| Δομή | |||
| Ισομέρεια | |||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | −7°C | ||
| Σημείο βρασμού | 196-197°C | ||
| Πυκνότητα | 1.146 kg/m³ | ||
| Χημικές ιδιότητες | |||
| Επικινδυνότητα | |||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Η σαλικυλαλδεΰδη[1] (αγγλικά salicylaldehyde) είναι αρωματική οργανική χημική ένωση, που περιέχει άνθρακα, υδρογόνο και οξυγόνο, με μοριακό τύπο C7H6O2, αλλά συμβολίζεται συχνότερα με τον ημισυντακτικό της τύπο (C6H4)(2-ΟΗ)CHO.[2]
Ο τύπος αυτός δείχνει ότι η βενζαλδεΰδη αποτελείται δομικά από μια βενζοομάδα (-C6H4-), μια υδροξυλομάδα (-ΟΗ) συνδεμένη με το #2 άτομο άνθρακα του βενζολικού δακτυλίου και μια φορμυλομάδα (-CHO). Πιο συγκεκριμένα, αποτελεί μια από τις τρεις (3) ισομερείς υδροξυβενζαλδεΰδες. Οι άλλες δύο (2) υδροξυβενζαλδεΰδες είναι η 3-υδροξυβενζαλδεΰδη [(C6H4)(3-ΟΗ)CHO] και η 4-υδροξυβενζαλδεΰδη [(C6H4)(4-ΟΗ)CHO]. Η χημικά καθαρή σαλικυλαλδεΰδη, στις «κανονικές συνθήκες περιβάλλοντος», δηλαδή σε θερμοκρασία 25°C και υπό πίεση 1 atm, είναι άχρωμο ελαιώδες υγρό με οσμή πικραμύγδαλου, όταν οι ατμοί της βρίσκονται σε υψηλή συγκέντρωση. Η σαλικυλαλδεΰδη είναι κομβική πρόδρομη ένωση για μια ποικιλία χηλικών ενώσεων, κάποιες από τις οποίες είναι εμπορικά σημαντικές. Εκτός από τη «μητρική» σαλικυλαλδεΰδη, ο όρος επεκτείνεται και σε σειρά «θυγατρικών» παραγώγων της, που ενίοτε αναφέρονται συλλύβδην (μαζί με τη «μητρική» ένωση) «σαλικυλαλδεΰδες».
Φυσική παρουσία[Επεξεργασία | επεξεργασία κώδικα]
Η σαλυκυλαλδεΰδη αναγνωρίστηκε χαρακτηριστικό αρωματικό συστατικό του φαγόπυρου.[3]
Αποτελεί επίσης συστατικό του καστορέλαιου, που παράγεται από το υγρό περιεχόμενο των καστορικών σάκων των ώριμων Βορειοαμερικανικών και Ευροπαϊκών καστόρων, και χρησιμοποιείται στην αρωματοποιία.
Επιπλέον, η σαλυκυλαλδεΰδη παρουσιάζεται σε αμυντικές εκκρήσεις προνυμφών διαφόρων σκαθάριών των φύλλων, σε είδη που ανήκουν στο υποφύλο Chrysomelina.[4] Παράδειγμα τέτοιου σκαθαριού, που παράγει σαλικυλαλδεΰδη είναι το κόκκινο σκαθάρι φύλλων λεύκας, με βιολογική ονομασία Chrysomela populi.
Παραγωγή[Επεξεργασία | επεξεργασία κώδικα]
Η σαλικυλαλδεΰδη παράγεται από φαινόλη (PhOH) και χλωροφόρμιο (CHCl3), μετά από συνθέρμανση με υδροξείδιο του νατρίου (NaOH) ή υδροξείδιο του καλίου (KOH) σύμφωνα με την αντίδραση Reimer–Tiemann :[5]
Εναλλακτικά, παράγεται με αντιδράσεις συμπύκνωσης φαινολών ή κάποιων παραγώγων τους με φορμαλδεΰδη (ΗCHO), που δίνουν 2-υδροξυβενζυλική αλκοόλη [(C6H4)(2-ΟΗ)CH2OH] , που μπορεί, με τη σειρά της, να οξειδωθεί σε σαλικυλαλδεΰδη.
Οι «θυγατρικές» σαλικυλαλδεΰδες μπορούν να παραχθούν από την αντίστοιχη φαινόλη, μέσω της αντίδρασης Νταφ (Duff reaction) ή μετά από επίδραση με παραφορμαλδεΰδη, με την παρουσία χλωριούχου μαγνησίου (MgCl2) και μιας βάσης.[6]
Αντιδράσεις και εφαρμογές[Επεξεργασία | επεξεργασία κώδικα]
H σαλικυλαλδεΰδη χρησιμοποιείται ως πρόδρομη ένωση για τις ακόλουθες:
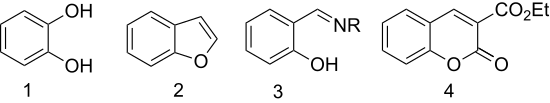
2. Βενζοφουράνιο
3. N-αλκυλοσαλικυλαλδεϋδιμίνη
4. 3-καρβαιθοξυκουμααρίνιο
Κατεχόλη[Επεξεργασία | επεξεργασία κώδικα]
H σαλικυλαλδεΰδη μπορεί να οξειδωθεί από το υπεροξείδιο του υδρογόνου (H2O2), δίνιοτας κατεχόλη. (Αντίδραση Ντεϊκίν, Dakin reaction):[7]
Αλκυλίωση και αιθεροποίηση[Επεξεργασία | επεξεργασία κώδικα]
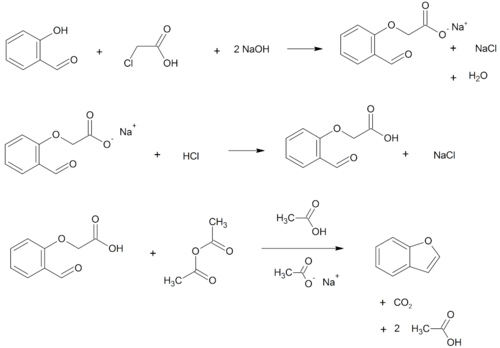
Αρχικά με O-αλκυλίωση σαλικυλαλδεΰδης με χλωραιθανικό οξύ (ClCH2COOH) και έπειτα με ενδομοριακή αφυδάτωση, σε συνθήκες αιθεροποίησης, παράγεται τελικά βενζοφουράνιο.[8]
Αζωτούχα παράγωγα[Επεξεργασία | επεξεργασία κώδικα]
Η σαλικυλαδεΰδη μετατρέπεται σε χηλικούς συναρμοτές μετά από αντίδραση συμπύκνωσης με αμίνες. Για παράδειγμα, με 1,2-αιθανοδιαμίνη (H2NCH2CH2NH2) συμπυκνώνεται δίνοντας το συναρμοτή σέιλεν. Με υδροξυλαμίνη (NH2OH) δίνει σαλικυλαδοξίμη [(C6H4)(2-OH)CH=NOH]. Με αλκυλαμίνη (RNH2) δίνει N-αλκυλοσαλικυλιμίνη [(C6H4)(2-OH)CH=NR]:
Αλδολική συμπύκνωση[Επεξεργασία | επεξεργασία κώδικα]
Η σαλικυλαδεΰδη με μηλονικό διαιθυλεστέρα (CH3CH2OOCCH2COOCH2CH3) δίνει 3-καρβαιθοξυκουμαρίνιο μέσω αλδολικής συμπύκνωσης [9]
Κουμαρίνη[Επεξεργασία | επεξεργασία κώδικα]
Η σαλικυλαδεΰδη με αιθανικό ανυδρίτη (CH3CO3CH3) δίνει κουμαρίνη, μέσω σύνθεσης Πέρκινσχεν (Perkinschen synthesis)[10]:

Δείτε επίσης[Επεξεργασία | επεξεργασία κώδικα]
Πηγές[Επεξεργασία | επεξεργασία κώδικα]
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Δημήτριου Ν. Νικολαΐδη: Ειδικά μαθήματα Οργανικής Χημείας, Θεσσαλονίκη 1983.
Αναφορές και σημειώσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Δείτε τις εναλλακτικές ονομασίες στον παρακείμενο πίνακα πληροφοριών χημικής ένωσης.
- ↑ Merck Index, 11th Edition, 8295
- ↑ Janeš, D.; Kreft, S. (2008). «Salicylaldehyde is a characteristic aroma component of buckwheat groats». Food Chemistry 109 (2): 293–298. doi:.
- ↑ Pauls, G., Becker, T., et al. (2016).
- ↑ Πρότυπο:UllmannCS1 maint: Multiple names: authors list (link)Πρότυπο:Ullmann
- ↑ Trond Vidar Hansen; Lars Skattebøl (2005), «Ortho-Formylation of Phenols; Preparation of 3-Bromosalicylaldehyde», Org. Synth. 82: 64
- ↑ Dakin, H. D. (1923), «Catechol», Org. Synth. 3: 28, http://www.orgsyn.org/orgsyn/pdfs/CV1P0149.pdf; Coll. Vol. 1: 149
- ↑ Burgstahler, A. W.; Worden, L. R. (1966), «Coumarone», Org. Synth. 46: 28, http://www.orgsyn.org/orgsyn/pdfs/CV5P0251.pdf; Coll. Vol. 5: 251
- ↑ Horning, E. C.; Horning, M. G.; Dimmig, D. A. (1948), «3-Carbethoxycoumarin», Org. Synth. 28: 24, http://www.orgsyn.org/orgsyn/pdfs/CV3P0165.pdf; Coll. Vol. 3: 165
- ↑ Erich Koepp, Fritz Vögtle: . In: . Band 1987, Nr. 2, Januar 1987, doi:10.1055/s-1987-27880.
| ||||||||||||||||||||||||||
|


![54x54εσ[νεκρός σύνδεσμος]](http://upload.wikimedia.org/wikipedia/commons/thumb/2/29/Salicylaldehyde.svg/220px-Salicylaldehyde.svg.png)

![50x50εσ[νεκρός σύνδεσμος]](http://upload.wikimedia.org/wikipedia/commons/thumb/e/ed/Brenzcatechin.svg/220px-Brenzcatechin.svg.png)
