Άτομο
| Το λήμμα δεν περιέχει πηγές ή αυτές που περιέχει δεν επαρκούν. |
| Άτομο του Ηλίου | ||||||||
|---|---|---|---|---|---|---|---|---|
 | ||||||||
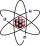
| Μία αναπαράσταση του ατόμου του ηλίου, όπου με ροζ χρώμα απεικονίζεται ο πυρήνας και το ηλεκτρονικό νέφος του με μαύρο χρώμα. Ο πυρήνας (επάνω δεξιά) είναι στην ουσία σφαιρικά συμμετρικός, ενώ σε μεγαλύτερους πυρήνες αυτό δεν ισχύει πάντοτε. Η μαύρη ταινία αναπαριστά το μήκος ενός Ώνγκστρεμ, που ισούται με 10−10 m ή με 100.000 fm. | ||||||||
| Κατάταξη | ||||||||
|
Το μικρότερο αναγνωρίσιμο τμήμα ενός χημικού στοιχείου. | ||||||||
| Ιδιότητες | ||||||||
|
Στη χημεία και τη φυσική, το άτομο (ετυμ. = άτμητο < α στερητ. + τέμνω) είναι το μικρότερο σωματίδιο ενός χημικού στοιχείου το οποίο διατηρεί τις χημικές ιδιότητες του στοιχείου με την έννοια ότι παραμένει αμετάβλητο κατά την εξέλιξη ενός χημικού φαινομένου (χημική αντίδραση). Η λέξη άτομο αρχικά, σύμφωνα με τους αρχαίους Έλληνες ατομικούς φιλοσόφους Δημόκριτο και Επίκουρο, εννοούσε το μικρότερο δυνατό άτμητο σωματίδιο, αλλά στη συνέχεια ο όρος αυτός απέκτησε ειδικό νόημα στην επιστήμη όταν βρέθηκε πως και τα άτομα αποτελούνται από μικρότερα υποατομικά σωματίδια.
Τα τρία βασικά συστατικά του ατόμου[Επεξεργασία | επεξεργασία κώδικα]
Όλα τα άτομα, εκτός του "πρώτιου" (1Η, υδρογόνο-1) που είναι ισότοπο του χημικού στοιχείου υδρογόνο και δεν έχει νετρόνια, αποτελούνται από τρεις τύπους υποατομικών σωματιδίων τα οποία διέπουν τις ιδιότητες των πρώτων:
- ηλεκτρόνια, τα οποία έχουν αρνητικό φορτίο και έχουν τη μικρότερη μάζα.
- πρωτόνια, τα οποία έχουν θετικό φορτίο και έχουν μάζα περίπου 1836 φορές μεγαλύτερη από αυτή των ηλεκτρονίων και
- νετρόνια, τα οποία δεν φέρουν φορτίο και έχουν μάζα περίπου 1838 φορές μεγαλύτερη από αυτή των ηλεκτρονίων.
Τα πρωτόνια και τα νετρόνια ονομάζονται νουκλεόνια και σχηματίζουν τον συμπαγή ατομικό πυρήνα. Τα ηλεκτρόνια σχηματίζουν ηλεκτρονικό νέφος το οποίο περιβάλλει τον πυρήνα.
Τα άτομα των διαφόρων χημικών στοιχείων διαφέρουν στον αριθμό των υποατομικών σωματιδίων που περιέχουν. Έτσι για παράδειγμα, ενώ το άτομο του κοινού οξυγόνου αποτελείται από 8 πρωτόνια, 8 νετρόνια και 8 ηλεκτρόνια, το άτομο του κοινού άνθρακα αποτελείται από 6 πρωτόνια, 6 νετρόνια και 6 ηλεκτρόνια.
Ο αριθμός των πρωτονίων σε ένα άτομο (ο λεγόμενος ατομικός αριθμός) καθορίζει το στοιχείο του ατόμου, είναι δηλαδή κατά κάποιο τρόπο η ταυτότητά του.
Ο αριθμός των νετρονίων, για ένα συγκεκριμένο στοιχείο, δεν είναι μοναδικός και καθορίζει το ισότοπο του συγκεκριμένου στοιχείου. Έτσι για παράδειγμα, υπάρχουν στη φύση και σε διάφορα ποσοστά, δύο είδη ατόμων άνθρακα: το ένα περιέχει στον πυρήνα του 6 νετρόνια ενώ το άλλο 7 νετρόνια. Και τα δύο όμως είδη ατόμων έχουν 6 πρωτόνια.
Τα άτομα είναι ηλεκτρικά ουδέτερα αν έχουν ίσο αριθμό πρωτονίων και ηλεκτρονίων.
Τα ηλεκτρόνια έχουν τη δυνατότητα, κατά την εξέλιξη των διαφόρων χημικών φαινομένων, να μεταφερθούν σε άλλα γειτονικά άτομα ή ακόμη και να μοιρασθούν μεταξύ τους. Άτομα τα οποία έχουν έλλειμμα ή περίσσεια ηλεκτρονίων ονομάζονται ιόντα.
Ο αριθμός των πρωτονίων και νετρονίων στον ατομικό πυρήνα μπορεί επίσης να αλλάζει, μέσω της πυρηνικής σύντηξης ή της πυρηνικής σχάσης.
Τα άτομα ενός χημικού στοιχείου έχουν τη δυνατότητα να δημιουργούν χημικούς δεσμούς με όμοια άτομα ή με άτομα άλλων χημικών στοιχείων. Στην πρώτη περίπτωση σχηματίζεται μόριο του χημικού στοιχείου, ενώ στη δεύτερη περίπτωση δημιουργείται μόριο χημικής ένωσης. Για παράδειγμα, 2 άτομα οξυγόνου συνδεδεμένα μεταξύ τους σχηματίζουν 1 μόριο οξυγόνου (O2), ενώ 1 μόριο νερού (H2O) είναι συνδυασμός 2 ατόμων υδρογόνου και 1 ατόμου οξυγόνου.
Δομή του ατόμου - Υποατομικά σωματίδια[Επεξεργασία | επεξεργασία κώδικα]
Γενικά[Επεξεργασία | επεξεργασία κώδικα]

Παρόλο που το όνομα άτομο δόθηκε τη στιγμή που τα άτομα πιστευόταν πως ήταν αδιαίρετα, τώρα είναι γνωστό πως ένα άτομο μπορεί να διαχωριστεί σε έναν αριθμό μικρότερων συστατικών.
Το πρώτο από αυτά που ανακαλύφθηκε ήταν το αρνητικά φορτισμένο ηλεκτρόνιο, το οποίο εύκολα μπορεί να αποβάλλει 1 άτομο κατά τον ιονισμό του. Τα ηλεκτρόνια σχηματίζουν ένα σύννεφο, το ηλεκτρονιακό νέφος, γύρω από ένα συμπαγές σώμα το οποίο περιέχει όλο το θετικό φορτίο του ατόμου, τον ατομικό πυρήνα. Ο πυρήνας με τη σειρά του αποτελείται από νουκλεόνια: θετικά φορτισμένα πρωτόνια και αφόρτιστα νετρόνια.
Πριν το 1961, τα υποατομικά σωματίδια πιστευόταν πως ήταν μόνο τα πρωτόνια, τα νετρόνια και ηλεκτρόνια. Ωστόσο, τα πρωτόνια και τα νετρόνια αυτά καθ' αυτά γνωρίζουμε σήμερα πως αποτελούνται από ακόμα μικρότερα σωματίδια, τα λεγόμενα κουάρκ. Επιπλέον, το ηλεκτρόνιο είναι γνωστό πως έχει έναν σχεδόν χωρίς μάζα "σύντροφο", το νετρίνο. Και τα δύο, ηλεκτρόνιο και νετρίνο, είναι λεπτόνια.
Συνηθέστερα τα άτομα αποτελούνται μόνο από κουάρκ και λεπτόνια πρώτης γενιάς.
Το πρωτόνιο αποτελείται από 2 πάνω (up) κουάρκ και 1 κάτω (down), ενώ το νετρόνιο αποτελείται από 1 πάνω (up) και 2 κάτω (down). Παρόλο που δεν συναντώνται στη συνηθισμένη ύλη, οι άλλες δύο πιο βαρείς γενιές κουάρκ και λεπτονίων μπορούν να παραχθούν σε συγκρούσεις υψηλής ενέργειας.
Το υποατομικά σωματίδια φορείς δυνάμεων, γλουόνια (ή κολλητόνια), είναι επίσης σημαντικά στα άτομα. Τα ηλεκτρόνια παραμένουν στο άτομο λόγω δυνάμεων κβαντομηχανικής φύσης οι οποίες αναπτύσσονται μεταξύ αυτών και του πυρήνα. Τα πρωτόνια και τα νετρόνια συγκρατούνται μαζί στον πυρήνα με τη βοήθεια των γλουονίων, φορείς της ισχυρής πυρηνικής δύναμης.
Τα ηλεκτρόνια[Επεξεργασία | επεξεργασία κώδικα]
Η χημική συμπεριφορά των ατόμων οφείλεται στις αλληλεπιδράσεις μεταξύ των ηλεκτρονίων. Τα ηλεκτρόνια των ατόμων παραμένουν σε προβλέψιμες ηλεκτρονιακές δομές. Αυτές οι δομές καθορίζονται από τη κβαντομηχανική συμπεριφορά των ηλεκτρονίων μέσα στο δυναμικό του πυρήνα. Ο κύριος κβαντικός αριθμός καθορίζει συγκεκριμένους ηλεκτρονιακούς φλοιούς (ή αλλιώς στιβάδες) συγκεκριμένης ενέργειας η κάθε μία. Γενικά, όσο μεγαλύτερη είναι η ενέργεια ενός φλοιού τόσο πιο μακριά βρίσκεται από τον πυρήνα. Τα ηλεκτρόνια στον εξώτατο φλοιό ονομάζονται ηλεκτρόνια σθένους και έχουν την μεγαλύτερη επίδραση στη χημική συμπεριφορά του ατόμου επειδή μπορούν εύκολα να σχηματίσουν χημικούς δεσμούς. Τα εσωτερικά ηλεκτρόνια, αυτά που δεν ανήκουν δηλαδή στο φλοιό σθένους, επίσης παίζουν κάποιο ρόλο, μικρότερο όμως λόγω της θωράκισης του θετικά φορτισμένου πυρήνα.
Ένας ηλεκτρονιακός φλοιός μπορεί να συγκρατήσει μέχρι 2n2 ηλεκτρόνια, όπου n είναι ο κύριος κβαντικός αριθμός του φλοιού αυτού. Ο τελευταίος (αυτός με το μεγαλύτερο n) κατειλημμένος φλοιός, ακόμα κι αν αυτός έχει 1 μόνο ηλεκτρόνιο, ονομάζεται φλοιός σθένους. Στην πιο σταθερή θεμελιώδη κατάσταση, τα ηλεκτρόνια ενός ατόμου συμπληρώνουν τους φλοιούς με σειρά αυξανόμενης ενέργειας. Κάτω από συγκεκριμένες συνθήκες ένα ηλεκτρόνιο μπορεί να διεγερθεί σε ένα υψηλότερης ενέργειας φλοιό (για παράδειγμα, απορροφώντας ενέργεια από μία εξωτερική πηγή και μεταπηδώντας σε έναν υψηλότερο φλοιό), αφήνοντας μία κενή θέση σε χαμηλότερο φλοιό. Το διεγερμένο ηλεκτρόνιο, μόλις πάψει η εξωτερική επίδραση, μεταπηδά σε χαμηλότερο φλοιό, εκπέμποντας ενέργεια ίση με τη διαφορά ενεργειών του αρχικού και τελικού φλοιού, υπό τη μορφή φωτονίων και το άτομο επιστρέφει στη θεμελιώδη κατάσταση.
Εκτός του κυρίως κβαντικού αριθμού, ένα ηλεκτρόνιο χαρακτηρίζεται από άλλους 3 κβαντικούς αριθμούς. Οι τέσσερις σημαντικότεροι αυτοί κβαντικοί αριθμοί αποτελούν τις παραδεκτές λύσεις της κυματικής εξίσωσης του Έρβιν Σρέντινγκερ (Erwin Schrödinger): τον αζιμουθιακό κβαντικό αριθμό ℓ (ο οποίος περιγράφει την τροχιακή στροφορμή του ηλεκτρονίου), τον μαγνητικό κβαντικό αριθμό ml (ο οποίος περιγράφει τη διεύθυνση του διανύσματος της στροφορμής), και τον κβαντικό αριθμό του σπιν ms (ο οποίος περιγράφει τη διεύθυνση της εσωτερικής στροφορμής του ηλεκτρονίου). Για τον συμβολισμό του κβαντικού αριθμού ℓ χρησιμοποιούνται τα γράμματα s, p, d και f τα οποία αντιστοιχούν σε ℓ = 0, 1, 2 και 3 και περιγράφουν τη μορφή του ατομικού τροχιακού. Στα περισσότερα άτομα διαφορετικά ℓ περιγράφουν και καταστάσεις διαφορετικής ενέργειας. Οι διαφορές αυτές καθορίζουν τη λεπτή δομή του ατόμου. Διαφορετικά m δίνουν εκφυλισμένες καταστάσεις μόνο στην περίπτωση απουσίας εξωτερικού μαγνητικού πεδίου. Αντίθετα, εμφανίζεται το φαινόμενο Τσίμαν κατά το οποίο οι εκφυλισμένες καταστάσεις διαχωρίζονται καθορίζοντας έτσι την υπέρλεπτη δομή του ατόμου.
Ο πυρήνας[Επεξεργασία | επεξεργασία κώδικα]
Τα πρωτόνια και νετρόνια που αποτελούν τον πυρήνα ονομάζονται νουκλεόνια. Τα νουκλεόνια συγκροτούνται μεταξύ τους στο πυρήνα με την ισχυρή πυρηνική δύναμη.
Οι πυρήνες υπόκεινται σε μετασχηματισμούς κατά τους οποίους μπορούν να μεταβάλλουν τον αριθμό των πρωτονίων και νετρονίων που περιέχουν, μία διαδικασία η οποία ονομάζεται ραδιενεργός διάσπαση ή Πυρηνική σχάση. Όταν πυρηνικοί μετασχηματισμοί λαμβάνουν χώρα τυχαία, η διαδικασία αυτή ονομάζεται ραδιενέργεια. Οι ραδιενεργές διασπάσεις μπορούν να πραγματοποιηθούν με μία σειρά διαφορετικών τρόπων, αλλά ο πιο συνήθης είναι μέσω της διάσπασης άλφα (εκπομπή πυρήνων ηλίου) και διάσπαση βήτα (εκπομπή ηλεκτρονίων). Διασπάσεις στις οποίες συμμετέχουν ηλεκτρόνια ή ποζιτρόνια οφείλονται στην ασθενή πυρηνική αλληλεπίδραση.
Επιπλέον, όπως τα ηλεκτρόνια του ατόμου, τα νουκλεόνια του πυρήνα μπορούν να διεγερθούν σε καταστάσεις υψηλότερης ενέργειας. Ωστόσο, αυτού του είδους οι μεταβάσεις απαιτούν χιλιάδες φορές περισσότερη ενέργεια από ότι οι διεγέρσεις ηλεκτρονίων. Όταν ένας διεγερμένος πυρήνας εκπέμψει ένα φωτόνιο για να επιστρέψει στη θεμελιώδη κατάσταση, το φωτόνιο έχει πολύ υψηλή ενέργεια και ονομάζεται ακτίνες γάμα.
Πυρηνικοί μετασχηματισμοί λαμβάνουν χώρα επίσης σε πυρηνικές αντιδράσεις. Στη πυρηνική σύντηξη, δύο ελαφρύτεροι πυρήνες συνδυάζονται σε έναν βαρύτερο πυρήνα. Στην πυρηνική σχάση, ένας βαρύς πυρήνας διαχωρίζεται σε δύο ή περισσότερους ελαφρύτερους πυρήνες.
Τα άτομα είναι πολύ μικρότερα του μήκους κύματος του φωτός που η ανθρώπινη όραση μπορεί να ανιχνεύσει, επομένως τα άτομα δεν μπορούν να φανούν με χρήση οπτικού μικροσκοπίου, οποιουδήποτε τύπου. Ωστόσο, υπάρχουν μέθοδοι ανίχνευσης και απεικόνισής της θέσης των ατόμων στην επιφάνεια ενός στερεού σώματος ή ενός λεπτού υμενίου (πολύ λεπτές μεμβράνες, όπως η επιφάνεια μίας φυσαλίδας). Οι μέθοδοι αυτοί περιλαμβάνουν: την ηλεκτρονική μικροσκοπία όπως στην ηλεκτρονική μικροσκοπία σάρωσης φαινομένου σήραγγας (STM)], τη μικροσκοπία ατομικής δύναμης (AFM), το μαγνητικό πυρηνικό συντονισμό (NMR) και τη μικροσκοπία ακτίνων X.
Καθώς το ηλεκτρονικό νέφος δεν έχει αυστηρά καθορισμένα όρια, το μέγεθος του ατόμου δε μπορεί να οριστεί εύκολα. Για άτομα τα οποία μπορούν να σχηματίσουν στερεά κρυσταλλικά πλέγματα, η απόσταση μεταξύ των κέντρων γειτονικών ατόμων μπορεί εύκολα να προσδιοριστεί με χρήση της περίθλασης ακτίνων Χ, δίνοντας μία εκτίμηση για το μέγεθος των ατόμων. Για κάθε άτομο, για την περιγραφή του μεγέθους, μπορεί να χρησιμοποιηθεί η ακτίνα στην οποία είναι πιο πιθανό να βρεθούν τα ηλεκτρόνια σθένους.
Για παράδειγμα, το μέγεθος του ατόμου του υδρογόνου εκτιμάται περίπου 1,0586×10−10m (διπλάσια τιμή από αυτή της ακτίνας του Bohr). Αναφορικά, το μέγεθος του πρωτονίου (το μοναδικό σωματίδιο στον πυρήνα του υδρογόνου), είναι περίπου 10-15. Δηλαδή, ο λόγος του μεγέθους του ατόμου του υδρογόνου προς το μέγεθος του πυρήνα του είναι περίπου 100.000:1. Αν το άτομο είχε το μέγεθος ενός σταδίου ποδοσφαίρου, ο πυρήνας θα είχε το μέγεθος ενός σβόλου στο κέντρο του. Τα άτομα δηλαδή είναι πρακτικά "άδεια". Σχεδόν όλη η μάζα του ατόμου βρίσκεται στον πυρήνα του, ωστόσο σχεδόν όλος ο χώρος ενός ατόμου καταλαμβάνεται από τα ηλεκτρόνια του.
Άτομα διαφόρων στοιχείων έχουν διαφορετικά μεγέθη, όμως τα μεγέθη αυτά δεν εξαρτώνται γραμμικά από τη μάζα του ατόμου. Το μέγεθος του είναι σχεδόν το ίδιο, εντός των ορίων ενός συντελεστή 2. Ο λόγος είναι ότι τα βαρύτερα στοιχεία έχουν μεγάλο θετικό φορτίο στον πυρήνα, το οποίο έλκει ισχυρά τα ηλεκτρόνια στο κέντρο του πυρήνα. Αυτό συστέλλει το μέγεθος του ηλεκτρικού νέφους και κατά αυτό τον τρόπο, περισσότερα ηλεκτρόνια καταλαμβάνουν μόνο λίγο περισσότερο όγκο.
Η θερμοκρασία μιας μεγάλης ομάδας από άτομα είναι το μέτρο της μέσης κινητικής ενέργειας αυτών. Στους 0 βαθμούς Κέλβιν (θερμοκρασία απόλυτου μηδενός) τα άτομα κινούνται απειροελάχιστα, πρακτικά δηλαδή είναι ακίνητα. Καθώς η θερμοκρασία του συστήματος αυξάνεται, η κινητική ενέργεια των σωματιδίων αυξάνεται, όπως επίσης αυξάνεται και η ταχύτητά τους. Σε θερμοκρασία δωματίου, τα άτομα στη φάση του αερίου κινούνται με ταχύτητες 500 m/s (1800 km/h).
Χημικά στοιχεία - Ισότοπα - Ιόντα[Επεξεργασία | επεξεργασία κώδικα]
Τα άτομα γενικά κατηγοριοποιούνται βάση του ατομικού τους αριθμού (Z), ο οποίος ανταποκρίνεται στον αριθμό των πρωτονίων του ατόμου.
Ο ατομικός αριθμός καθορίζει το στοιχείο του ατόμου. Όλα τα άτομα με τον ίδιο ατομικό αριθμό, χαρακτηρίζονται από μία σειρά ίδιων φυσικών και χημικών ιδιοτήτων. Τα στοιχεία μπορούν να ταξινομηθούν, όπως στον περιοδικό πίνακα, με σειρά αυξανομένου ατομικού αριθμού.
Η ατομική μάζα (Ar) (ή μαζικός αριθμός, ή αριθμός νουκλεονίων) ενός στοιχείου είναι το άθροισμα των πρωτονίων και των νετρονίων ενός ατόμου, ονομαζόμενη κατ΄ αυτό τον τρόπο λόγω του γεγονότος ότι η μάζα κάθε πρωτονίου ή νετρονίου είναι περίπου ίση με 1amu. Ο αριθμός των νετρονίων Α-Ζ ενός ατόμου δεν έχει επίδραση στο είδος του στοιχείου. Κάθε στοιχείο έχει διάφορα είδη ατόμων, όλα με ισάριθμα πρωτόνια και ηλεκτρόνια, αλλά με διαφορετικό αριθμό νετρονίων. Κάθε ένα από αυτά έχει τον ίδιο ατομικό αριθμό αλλά διαφορετική ατομική μάζα. Αυτά τα άτομα ονομάζονται ισότοπα ενός στοιχείου και μπορεί να απαντώνται στη φύση, μπορεί όμως να είναι και εργαστηριακά δημιουργήματα.
Η ατομική μάζα η οποία αναφέρεται σε κάθε στοιχείο του περιοδικού πίνακα είναι ο μέσος όρος των μαζών των ισοτόπων του στοιχείου τα οποία βρίσκονται στη φύση, αντισταθμισμένες με το ποσοστό συμμετοχής τους στο φυσικό στοιχείο.
Το απλούστερο άτομο είναι το ισότοπο του υδρογόνου, πρώτιο, το οποίο έχει ατομικό αριθμό 1 και ατομική μάζα 1. Αποτελείται δηλαδή από 1 πρωτόνιο και 1 ηλεκτρόνιο. Το ισότοπο του υδρογόνου το οποίο περιέχει στον πυρήνα 1 νετρόνιο ονομάζεται δευτέριο ή υδρογόνο-2. Το ισότοπο του υδρογόνου το οποίο περιέχει στον πυρήνα 2 νετρόνια ονομάζεται τρίτιο ή υδρογόνο-3. Το τρίτιο είναι ασταθές και διασπάται με μία διαδικασία η οποία ονομάζεται ραδιενέργεια. Σχεδόν όλα τα ισότοπα κάθε στοιχείου είναι ραδιενεργά και μόνο λίγα είναι σταθερά. Τα στοιχεία με ατομικό αριθμό 84 (πολώνιο) ή μεγαλύτερο δεν έχουν σταθερά ισότοπα και είναι όλα ραδιενεργά.
Σχεδόν όλα τα ελαφρύτερα από το ουράνιο (Z=92) στοιχεία έχουν αρκετά σταθερά ισότοπα ώστε να εμφανιστούν φυσικά στη Γη.
Αρκετά στοιχεία τα οποία δεν συναντώνται στη Γη έχουν βρεθεί παρόντα σε άστρα. Στοιχεία που δεν βρίσκονται φυσιολογικά στη φύση έχουν τεχνητά δημιουργηθεί με πυρηνικό βομβαρδισμό. Μέχρι αυτή τη στιγμή (2011), έχουν δημιουργηθεί τεχνητά στοιχεία με ατομικό αριθμό μέχρι και 118. Αυτά τα εξαιρετικά βαριά στοιχεία είναι γενικά πολύ ασταθή και διασπώνται γρήγορα.
Άτομα όπου έχουν χάσει ή αποκτήσει ηλεκτρόνια ονομάζονται ιόντα με θετικό (+) είτε με αρνητικό (-) φορτίο, και ονόματα κατιόντα και ανιόντα αντίστοιχα.
Χημικοί δεσμοί[Επεξεργασία | επεξεργασία κώδικα]
Ο αριθμός ηλεκτρονίων στον εξωτερικό φλοιό (τον φλοιό σθένους) ενός ατόμου διέπει τη δεσμική συμπεριφορά του. Συνεπώς, στοιχεία με τον ίδιο αριθμό ηλεκτρονίων σθένους ομαδοποιούνται σε στήλες στον περιοδικό πίνακα των στοιχείων. Τα αλκάλια αποτελούνται από 1 ηλεκτρόνιο στον εξωτερικό φλοιό, οι αλκαλικές γαίες από 2, τα αλογόνα από 7 κτλ.
Κάθε άτομο είναι γενικά περισσότερο ευσταθές όταν έχει συμπληρωμένο τον φλοιό σθένους. Κατ' επέκταση άτομα με συμπληρωμένο τον φλοιό σθένους (όπως τα ευγενή αέρια) σχηματίζουν λίγες χημικές ενώσεις. Αντιθέτως, άτομα με λίγα ηλεκτρόνια στον φλοιό σθένους είναι περισσότερο δραστικά. Επιπλέον, άτομα τα οποία χρειάζονται λίγα μόνο ηλεκτρόνια (όπως τα αλογόνα) για τη συμπλήρωση του φλοιού σθένους είναι επίσης αρκετά δραστικά. Το φθόριο είναι το πλέον δραστικό από όλα τα στοιχεία.
Τα άτομα όταν ενώνονται σε χημικές ενώσεις, προσπαθούν να αποκτήσουν την ελάχιστη ενέργεια. Αυτό μπορεί να γίνει με τους χημικούς δεσμούς που είναι: Το άτομο να μοιρασθεί κάποια ηλεκτρόνια με άλλα άτομα (ομοιοπολικός δεσμός), ή να ανταλλάξει ηλεκτρόνια με ένα άλλο άτομο (ετεροπολικός δεσμός). Υπάρχουν και άλλοι τύποι αλληλεπιδράσεων μεταξύ ατόμων όπως π.χ. οι μεταλλικοί δεσμοί, οι δεσμοί υδρογόνου, οι δεσμοί Φαν ντερ Βάαλς. Οι χημικοί δεσμοί είναι κβαντομηχανικής συμπεριφοράς και δεν εξηγούνται ικανοποιητικά με την κλασική φυσική. Ουσιαστικά, ο διαχωρισμός μεταξύ των διαφόρων δεσμών προκύπτει από τη διαφορετική ανά περίπτωση λύση της κυματοσυνάρτησης των ηλεκτρονίων μέσα στο δυναμικό των ατομικών πυρήνων.
Ατομικά φάσματα[Επεξεργασία | επεξεργασία κώδικα]
Υπό φυσιολογικές συνθήκες ένα άτομο βρίσκεται στη λεγόμενη θεμελιώδη στάθμη, δηλαδή σε κατάσταση ελάχιστης (χαμηλότερης) ενέργειας. Καταστάσεις μεγαλύτερης ενέργειας ονομάζονται διεγερμένες καταστάσεις. Ένα ηλεκτρόνιο μπορεί να μεταφερθεί από μία στάθμη χαμηλότερης ενέργειας σε μία υψηλότερης απορροφώντας ένα φωτόνιο με ενέργεια ίση με τη διαφορά ενεργειών των δύο σταθμών. Ένα ηλεκτρόνιο σε υψηλής ενέργειας στάθμη μπορεί να επανέλθει σε μια στάθμη χαμηλότερης ενέργειας εκπέμποντας ένα φωτόνιο. Καθώς τα ηλεκτρόνια σε κάθε στοιχείο χαρακτηρίζονται από συγκεκριμένες τιμές ενεργειακών επιπέδων, η εκπομπή φωτονίων από το κάθε άτομο δημιουργεί ένα μοναδικό φάσμα φωτός.
Αν διεγερθούν (π.χ. με θέρμανση ή ακτινοβόληση) τα άτομα, τα ηλεκτρόνια τους θα μεταφερθούν σε διεγερμένες καταστάσεις. Όταν αυτά τα ηλεκτρόνια και κατ' επέκταση και τα άτομα επιστρέψουν στην θεμελιώδη κατάσταση, παράγεται το φάσμα εκπομπής. Αν τα άτομα διεγερθούν από φως συνεχούς φάσματος, θα απορροφήσουν φωτόνια συγκεκριμένων μόνο μηκών κύματος, με ενέργεια ίση με τη διαφορά των ενεργειακών του επιπέδων. Η τελική εικόνα των κενών στο αρχικό φάσμα ονομάζεται φάσμα απορρόφησης.
Στη φασματοσκοπική ανάλυση, οι επιστήμονες χρησιμοποιούν έναν φασματογράφο για να μελετήσουν τα άτομα σε διάφορα αντικείμενα ή και στα άστρα. Χάρις στις ξεχωριστές φασματικές γραμμές που παράγει κάθε στοιχείο, είναι σε θέση να προβλέψουν τη χημική σύσταση των αντικειμένων που μελετούν.
Το ατομικό φάσμα δε βρίσκεται εξ ολοκλήρου μέσα στην περιοχή του ορατού ηλεκτρομαγνητικού φάσματος. Για παράδειγμα, οι μεταβάσεις υπέρλεπτης δομής (μαζί με αυτές και η σημαντική γραμμή στα 21cm) παράγουν χαμηλής ενέργειας ραδιοκύματα. Όταν τα ηλεκτρόνια κοντά στον πυρήνα εκπεμφθούν από το άτομο (για παράδειγμα με χρήση ακτινοβολίας βήτα), άλλα ηλεκτρόνια μεγαλύτερων σταθμών παίρνουν τη θέση των πρώτων εκπέμποντας υψηλής ενέργειας ακτίνες Χ.
Αντιύλη[Επεξεργασία | επεξεργασία κώδικα]
Η αντιύλη μπορεί να δημιουργήσει άτομα με τη βοήθεια ποζιτρονίων, αντιπρωτονίων και αντινετρονίων. Καθώς η αντιύλη είναι δύσκολο να παραχθεί και να αποθηκευτεί και επειδή όταν έρθει σε επαφή με την κανονική ύλη παρατηρείται άμεση αλληλοεξουδετέρωση μέσα σε έκλαμψη ενέργειας, έχει παραχθεί μόνο μία μικρή ποσότητα αντιυδρογόνου στο CERN κατά τη διάρκεια των πειραμάτων ATHENA και ATRAP με τη χρήση επιβραδυντή αντιπρωτονίων.
Άτομα και η Μεγάλη Έκρηξη[Επεξεργασία | επεξεργασία κώδικα]
Στα μοντέλα της Μεγάλης Έκρηξης, η νουκλεοσύνθεση της Μεγάλης Έκρηξης προβλέπει ότι τα πρώτα 1 έως 3 λεπτά δημιουργήθηκε σχεδόν όλη η ατομική μάζα στο σύμπαν. Κατά τη διάρκεια αυτής της διαδικασίας, πυρήνες υδρογόνου και ηλίου σχηματίστηκαν σε αφθονία, αλλά σχεδόν κανένα άλλο στοιχείο βαρύτερο του λιθίου. Το υδρογόνο αποτελεί περίπου το 75% των ατόμων του σύμπαντος, το ήλιο το 24% ενώ το υπόλοιπο 1% ανήκει στα υπόλοιπα στοιχεία. Ωστόσο, παρόλο που πυρήνες (πλήρως ιονισμένα άτομα) σχηματίστηκαν, ουδέτερα άτομα δεν μπόρεσαν να σχηματιστούν λόγω υψηλής θερμότητας.
379.000 χρόνια μετά τη Μεγάλη Έκρηξη, όταν η κοσμική θερμοκρασία είχε πέσει στους περίπου 3000K, οι συνθήκες έγιναν κατάλληλες ώστε οι πυρήνες να συλλάβουν ηλεκτρόνια και έτσι σχηματίστηκαν τα πρώτα ουδέτερα άτομα. Με το σχηματισμό των ατόμων, μόνο φωτόνια συγκεκριμένων ενεργειών μπορούσαν να απορροφηθούν και να εκπεμφθούν. Αυτά τα φωτόνια είναι ακόμα και σήμερα ανιχνεύσιμα στην κοσμική ακτινοβολία υποβάθρου.
Μετά την αρχική νουκλεοσύνθεση δεν δημιουργήθηκαν βαρύτερα στοιχεία παρά μόνο μετά τον σχηματισμό των πρώτων άστρων. Σε αυτά τα άστρα έλαβε χώρα η σύντηξη πυρήνων ατόμων προς βαρύτερους πυρήνες. Η παραγωγή των βαρύτερων αυτών πυρήνων τελικά επέτρεψε τον σχηματισμό πλανητών όπως η Γη.
Βλέπε επίσης[Επεξεργασία | επεξεργασία κώδικα]
Εξωτερικοί σύνδεσμοι[Επεξεργασία | επεξεργασία κώδικα]
|