Οξείδιο του διιωδίου
| Οξείδιο του διιωδίου | |||
|---|---|---|---|

| |||
| |||
| Γενικά | |||
| Όνομα IUPAC | Οξείδιο του διιωδίου | ||
| Άλλες ονομασίες | Ιωδοϋποϊώδες Διιωδιούχο οξυγόνο Οξείδιο του διιωδίου Υποϊωδιώδες ιώδιο Ανυδρίτης του υποϊωδιώδους οξέος | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | I2O | ||
| Μοριακή μάζα | 175,807 amu | ||
| Αριθμός CAS | 17739-47-8 | ||
| SMILES | O(I)I | ||
| InChI | 1S/I2O/c1-3-2 | ||
| PubChem CID | 14513630 | ||
| Δομή | |||
| Είδος δεσμού | Πολωμένος ομοιοπολικός | ||
| Γωνία δεσμού | 105° | ||
| Μοριακή γεωμετρία | Γωνιακή | ||
| Φυσικές ιδιότητες | |||
| Χημικές ιδιότητες | |||
| Επικινδυνότητα | |||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το (μον)οξείδιο του διιωδίου[1] [αγγλ. diiodine (mon)oxide] είναι ανόργανη δυαδική χημική ένωση με μοριακό τύπο I2O. Είναι το ισοδύναμο με τον ανυδρίτη του υποϊωδιώδους οξέος. Είναι ασταθής ουσία και είναι πολύ δύσκολο να απομονωθεί.
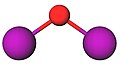
Δομή[Επεξεργασία | επεξεργασία κώδικα]
Η μοριακή γεωμετρία του οξειδίου του διιωδίου είναι γωνιακή, με μοριακή συμμετρία C2V, όπως οι αντίστοιχες του νερού και του υποϊωδιώδους οξέος, εξαιτίας των δύο (2) μονηρών ζευγών ηλεκτρονίων του ατόμου του οξυγόνου. Η δεσμική γωνία είναι ελαφρώς μεγαλύτερη από το κανονικό, εξαιτίας της στερεοχημικής απώθησης μεταξύ των (σχετικά) ογκωδών ατόμων ιωδίου.
| Δεσμοί[2][3] | |||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός | Ισχύς δεσμού |
|---|---|---|---|---|---|
| O-I | σ | 2sp³-5p | 14,4% Ι+ O– | 234 kJ/mol | |
| Γωνίες | |||||
| IOI | 105° | ||||
| Στατιστικό ηλεκτρικό φορτίο[4] | |||||
| O | -0,288 | ||||
| I | +0,144 | ||||
Παραγωγή[Επεξεργασία | επεξεργασία κώδικα]
Το οξείδιο του διιωδίου μπορεί να παραχθεί σε 96% θειικό οξύ (ως διαλύτη) και να εκχυλιστεί σε χλωριωμένους διαλύτες:[5]
Χημικές αντιδράσεις[Επεξεργασία | επεξεργασία κώδικα]
Το οξείδιο του διιωδίου αντιδρά με το νερό, σχηματίζοντας υποϊωδιώδες οξύ:
Δείτε επίσης[Επεξεργασία | επεξεργασία κώδικα]
Αναφορές και σημειώσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Για εναλλακτικές ονομασίες και συμβολισμούς δείτε τον πίνακα πληροφοριών.
- ↑ Τα δεδομένα προέρχονται από τους πίνακες δεδομένων των στοιχείων άνθρακα, πυριτίου και υδρογόνου και τις πηγές«Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και «Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982»
- ↑ «chem.tamu.edu» (PDF). Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 28 Ιανουαρίου 2018.
- ↑ Υπολογισμένο βάση του ιονισμού από τον παραπάνω πίνακα
- ↑ Furrow, Stanley D.; Schmitz, Guy E. (2019-09-01). «I2O in solution and volatility» (στα αγγλικά). Chemical Physics Letters 730: 186–190. doi:. ISSN 0009-2614. Bibcode: 2019CPL...730..186F. http://www.sciencedirect.com/science/article/pii/S0009261419304579.
| ||||||||

![{\displaystyle \mathrm {HgO+I_{2}{\xrightarrow[{CCl_{4}}]{96\%\ H_{2}SO_{4}}}HgI_{2}+I_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/664efc7593e8e1e64e0e52bf7fe9eb652c2dd97f)
