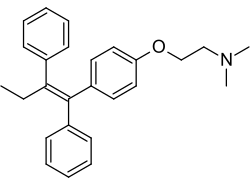
Ταμοξιφαίνη
 | |
 | |
| Ονομασία IUPAC | |
|---|---|
(Z)-2-[4-(1,2-Diphenylbut-1-enyl)phenoxy]-N,N-dimethylethanamine | |
| Κλινικά δεδομένα | |
| Εμπορικές ονομασίες | Nolvadex, Genox, Tamifen, άλλες[2] |
| AHFS/Drugs.com | monograph |
| MedlinePlus | a682414 |
| Δεδομένα άδειας | |
| Κατηγορία ασφαλείας κύησης | |
| Οδοί χορήγησης | Από το στόμα |
| Κυκλοφορία | |
| Κυκλοφορία |
|
| Φαρμακοκινητική | |
| Βιοδιαθεσιμότητα | ~100%[3][4] |
| Πρωτεϊνική σύνδεση | >99% (λευκωματίνη)[3][5] |
| Μεταβολισμός | Ήπαρ (CYP3A4, CYP2C9, CYP2D6)[3][6][7] |
| Μεταβολίτες | • Αφιμοξιφαίνη[7] • Ενδοξιφαίνη[7] • Νορενδοξιφαίνη[7] |
| Βιολογικός χρόνος ημιζωής | 5–7 ημέρες[3][7] |
| Απέκκριση | Κόπρανα: 65% Ούρα: 9% |
| Κωδικοί | |
| Αριθμός CAS | 10540-29-1 |
| Κωδικός ATC | L02BA01 |
| PubChem | CID 2733526 |
| IUPHAR/BPS | 1016 |
| DrugBank | DB00675 |
| ChemSpider | 2015313 |
| UNII | 094ZI81Y45 |
| KEGG | D08559 |
| ChEBI | CHEBI:41774 |
| ChEMBL | CHEMBL83 |
| Συνώνυμα | TMX; ICI-46474 |
| Χημικά στοιχεία | |
| Χημικός τύπος | C26H29NO |
| Μοριακή μάζα | 371.515 g/mol 563.638 g/mol (άλας κιτρικού) |
CN(C)CCOc1ccc(cc1)/C(c2ccccc2)=C(/CC)c3ccccc3 | |
InChI=1S/C26H29NO/c1-4-25(21-11-7-5-8-12-21)26(22-13-9-6-10-14-22)23-15-17-24(18-16-23)28-20-19-27(2)3/h5-18H,4,19-20H2,1-3H3/b26-25- Key:NKANXQFJJICGDU-QPLCGJKRSA-N | |
| (verify) | |
Η ταμοξιφαίνη, που πωλείται με την επωνυμία Nolvadex μεταξύ άλλων, είναι επιλεκτικός διαμορφωτής υποδοχέων οιστρογόνων που χρησιμοποιείται για την πρόληψη του καρκίνου του μαστού στις γυναίκες και τη θεραπεία του καρκίνου του μαστού σε γυναίκες και άνδρες.[8] Επίσης μελετάται για άλλους τύπους καρκίνου. Έχει χρησιμοποιηθεί για το σύνδρομο Albright. Η ταμοξιφαίνη λαμβάνεται συνήθως καθημερινά από το στόμα για πέντε χρόνια για τον καρκίνο του μαστού.[9]
Σοβαρές ανεπιθύμητες ενέργειες περιλαμβάνουν μικρό αυξημένο κίνδυνο καρκίνου της μήτρας, εγκεφαλικό επεισόδιο, προβλήματα όρασης και πνευμονική εμβολή.[9] Συχνές ανεπιθύμητες ενέργειες περιλαμβάνουν ακανόνιστες περιόδους, απώλεια βάρους και εξάψεις. Μπορεί να προκαλέσει βλάβη στο μωρό εάν ληφθεί κατά τη διάρκεια της εγκυμοσύνης ή του θηλασμού. Είναι επιλεκτικός ρυθμιστής του υποδοχέα οιστρογόνων (SERM) και λειτουργεί μειώνοντας την ανάπτυξη των καρκινικών κυττάρων του μαστού.[10] Είναι μέλος της ομάδας ενώσεων τριφαινυλαιθυλενίου.[11]
Η ταμοξιφαίνη παρασκευάστηκε αρχικά το 1962, από τη χημικό Ντόρα Ρίτσαρντσον.[12][13] Συμπεριλαμβάνεται στον κατάλογο βασικών φαρμάκων του Παγκόσμιου Οργανισμού Υγείας.[14] Η ταμοξιφαίνη διατίθεται ως γενόσημο φάρμακο.[9] Το 2017, ήταν η 251η πιο συχνά συνταγογραφούμενη φαρμακευτική αγωγή στις Ηνωμένες Πολιτείες, με περισσότερες από ένα εκατομμύριο συνταγές.[15][16]
Ιατρικές χρήσεις[Επεξεργασία | επεξεργασία κώδικα]
Η ταμοξιφαίνη έχει χρησιμοποιηθεί αποτελεσματικά για τη βελτίωση της ροής του αίματος, τη μείωση της συσταλτικότητας της μήτρας και του πόνου σε ασθενείς με δυσμηνόρροια.[17]
Καρκίνος του μαστού[Επεξεργασία | επεξεργασία κώδικα]
Η ταμοξιφαίνη χρησιμοποιείται για τη θεραπεία τόσο πρώιμων όσο και προχωρημένων καρκίνων του μαστού που είναι θετικοί στους οιστρογονικούς υποδοχείς (ER-θετική ή ER +) σε γυναίκες πριν και μετά την εμμηνόπαυση.[18] Επιπλέον, είναι η πιο κοινή ορμονική θεραπεία για τον καρκίνο του μαστού στους άντρες.[19] Είναι επίσης εγκεκριμένη από το FDA για την πρόληψη του καρκίνου του μαστού σε γυναίκες που διατρέχουν υψηλό κίνδυνο ανάπτυξης της νόσου.[20] Έχει εγκριθεί περαιτέρω για τη μείωση του αντίπλευρου καρκίνου (στον άλλο μαστό). Η χρήση της ταμοξιφαίνης συνιστάται για 10 χρόνια.[21]
Το 2006, η μεγάλη κλινική μελέτη STAR κατέληξε στο συμπέρασμα ότι η ραλοξιφαίνη είναι επίσης αποτελεσματική στη μείωση της συχνότητας εμφάνισης καρκίνου του μαστού. Ενημερωμένα αποτελέσματα μετά από κατά μέσο όρο 6,75 χρόνια παρακολούθησης διαπίστωσαν ότι η ραλοξιφαίνη διατηρεί το 76% της αποτελεσματικότητας της ταμοξιφαίνης στην πρόληψη του διηθητικού καρκίνου του μαστού, με 45% λιγότερους καρκίνους της μήτρας και 25% λιγότερους θρόμβους αίματος σε γυναίκες που λαμβάνουν ραλοξιφαίνη από ότι στις γυναίκες που λαμβάνουν ταμοξιφαίνη.[22][23][24]
Υπογονιμότητα[Επεξεργασία | επεξεργασία κώδικα]
Η ταμοξιφαίνη χρησιμοποιείται για επαγωγή ωορρηξίας στη θεραπεία της στειρότητας σε γυναίκες με ανωοθυλακιορρηκτικές διαταραχές. Δίνεται στις ημέρες τρία έως επτά του κύκλου μιας γυναίκας.[25]
Η ταμοξιφαίνη βελτιώνει τη γονιμότητα σε άνδρες με υπογονιμότητα, αναστέλλοντας τον άξονα υποθάλαμου-υπόφυσης-γονάδων (άξονας HPG) μέσω ανταγωνισμού των υποδοχέων οιστρογόνων και αυξάνοντας έτσι την έκκριση ωχρινοτρόπου ορμόνης (LH) και ορμόνης διέγερσης ωοθυλακίων (FSH) και αυξάνοντας την παραγωγή τεστοστερόνης στους όρχεις.[26]
Γυναικομαστία[Επεξεργασία | επεξεργασία κώδικα]
Η ταμοξιφαίνη χρησιμοποιείται για την πρόληψη και τη θεραπεία της γυναικομαστίας.[27][28] Λαμβάνεται ως προληπτικό μέτρο σε μικρές δόσεις ή χρησιμοποιείται κατά την έναρξη οποιωνδήποτε συμπτωμάτων όπως πόνος στη θηλή ή ευαισθησία. Άλλα φάρμακα λαμβάνονται για παρόμοιους σκοπούς όπως η κλομιφαίνη και τα φάρμακα κατά της αρωματάσης που χρησιμοποιούνται για να αποφευχθούν οι ανεπιθύμητες ενέργειες που σχετίζονται με την ορμόνη.
Πρώιμη εφηβεία[Επεξεργασία | επεξεργασία κώδικα]
Η ταμοξιφαίνη είναι χρήσιμη στη θεραπεία της περιφερικής πρώιμης εφηβείας, για παράδειγμα λόγω του συνδρόμου McCune-Albright, τόσο σε κορίτσια όσο και σε αγόρια.[29][30][31] Έχει βρεθεί ότι μειώνει την ταχύτητα ανάπτυξης και τον ρυθμό ωρίμανσης των οστών σε κορίτσια με πρόωρη εφηβεία, και ως εκ τούτου βελτιώνει το τελικό ύψος σε αυτά τα άτομα.
Αντενδείξεις[Επεξεργασία | επεξεργασία κώδικα]
Η ταμοξιφαίνη έχει έναν αριθμό αντενδείξεων, όπως γνωστή υπερευαισθησία στην ταμοξιφαίνη ή σε άλλα συστατικά, άτομα που λαμβάνουν ταυτόχρονα κουμαρινικά αντιπηκτικά και γυναίκες με ιστορικό φλεβικής θρομβοεμβολής (εν τω βάθει φλεβοθρόμβωση ή πνευμονική εμβολή).[6]
Παρενέργειες[Επεξεργασία | επεξεργασία κώδικα]
Μια έκθεση τον Σεπτέμβριο του 2009 από την Υπηρεσία Υγείας και Ανθρώπινης Υπηρεσίας για την Έρευνα και την Ποιότητα της Υγείας υποδηλώνει ότι η ταμοξιφαίνη, η ραλοξιφαίνη και η τιμπολόνη που χρησιμοποιούνται για τη θεραπεία του καρκίνου του μαστού μειώνουν σημαντικά τον διεισδυτικό καρκίνο του μαστού στη μέση ηλικία και τις ηλικιωμένες γυναίκες, αλλά αυξάνει επίσης τον κίνδυνο παρενεργειών.[32]
Καρκίνος του ενδομητρίου[Επεξεργασία | επεξεργασία κώδικα]
Η ταμοξιφαίνη είναι ένας επιλεκτικός διαμορφωτής υποδοχέα οιστρογόνων (SERM).[33] Παρόλο που είναι ανταγωνιστής στον ιστό του μαστού, ενεργεί ως μερικός αγωνιστής στο ενδομήτριο και έχει συνδεθεί με καρκίνο του ενδομητρίου σε ορισμένες γυναίκες. Ως εκ τούτου, οι ενδομητρικές αλλαγές, συμπεριλαμβανομένου του καρκίνου, είναι μεταξύ των παρενεργειών της ταμοξιφαίνης.[34] Με την πάροδο του χρόνου, ο κίνδυνος καρκίνου του ενδομητρίου μπορεί να διπλασιαστεί σε τετραπλασιασμό, πράγμα που είναι ο λόγος που η ταμοξιφαίνη χρησιμοποιείται συνήθως μόνο για πέντε χρόνια.[35]
Η Αμερικανική Εταιρεία Καρκίνου αναφέρει την ταμοξιφαίνη ως γνωστό καρκινογόνο, δηλώνοντας ότι αυξάνει τον κίνδυνο ορισμένων τύπων καρκίνου της μήτρας, ενώ μειώνει τον κίνδυνο επανεμφάνισης καρκίνου του μαστού.[36]
Καρδιαγγειακά και μεταβολικά[Επεξεργασία | επεξεργασία κώδικα]
Η θεραπεία με ταμοξιφαίνη μετεμμηνοπαυσιακών γυναικών σχετίζεται με ευεργετικά αποτελέσματα στα προφίλ λιπιδίων στον ορό. Ωστόσο, μακροπρόθεσμα δεδομένα από κλινικές δοκιμές δεν κατάφεραν να δείξουν καρδιοπροστατευτική δράση.[37] Σε ορισμένες γυναίκες, η ταμοξιφαίνη μπορεί να προκαλέσει ταχεία αύξηση της συγκέντρωσης τριγλυκεριδίων στο αίμα. Επιπλέον, υπάρχει αυξημένος κίνδυνος θρομβοεμβολής ειδικά κατά τη διάρκεια και αμέσως μετά από μείζονα χειρουργική επέμβαση ή περιόδους ακινησίας.[38] Η χρήση της ταμοξιφαίνης έχει αποδειχθεί ότι αυξάνει ελαφρώς τον κίνδυνο εν των βάθει φλεβοθρόμβωσης, πνευμονικής εμβολής και εγκεφαλικού επεισοδίου.[39]
Τοξικότητα στο ήπαρ[Επεξεργασία | επεξεργασία κώδικα]
Η ταμοξιφαίνη έχει συσχετιστεί με μια σειρά περιπτώσεων ηπατοτοξικότητας.[40] Έχουν αναφερθεί πολλές διαφορετικές ποικιλίες ηπατοτοξικότητας.
Η ταμοξιφαίνη μπορεί επίσης να προκαλέσει μη αλκοολική λιπώδη ηπατική νόσο σε παχύσαρκες και υπέρβαρες γυναίκες (όχι σε γυναίκες με κανονικό βάρος) με μέσο ρυθμό 40% μετά από χρήση ενός έτους με 20mg / ημέρα.[41]
Υπερδοσολογία[Επεξεργασία | επεξεργασία κώδικα]
Δεν έχει αναφερθεί οξεία υπερδοσολογία ταμοξιφαίνης σε ανθρώπους.[6] Σε μελέτες εύρους δόσεων, η ταμοξιφαίνη χορηγήθηκε σε πολύ υψηλές δόσεις σε γυναίκες (π.χ., 300 mg / m 2 ) και βρέθηκε να προκαλεί οξεία νευροτοξικότητα, όπως τρόμο, υπεραντανακλαστικότητα, ασταθές βάδισμα και ζάλη.[6] Αυτά τα συμπτώματα εμφανίστηκαν εντός τριών έως πέντε ημερών από τη θεραπεία και εξαφανίστηκαν εντός δύο έως πέντε ημερών από τη διακοπή της θεραπείας. Δεν παρατηρήθηκαν ενδείξεις μόνιμης νευροτοξικότητας.[6] Παρατηρήθηκε επίσης παράταση του QT με πολύ υψηλές δόσεις ταμοξιφαίνης. Δεν υπάρχει ειδικό αντίδοτο για υπερβολική δόση ταμοξιφαίνης.[6] Αντ 'αυτού, η θεραπεία πρέπει να βασίζεται σε συμπτώματα.[6]
Αλληλεπιδράσεις[Επεξεργασία | επεξεργασία κώδικα]
Οι ασθενείς με ποικίλες μορφές του γονιδίου CYP2D6 (που ονομάζεται επίσης απλά 2D6) ενδέχεται να μην έχουν τα πλήρη οφέλη από την ταμοξιφαίνη λόγω του πολύ αργού μεταβολισμού του προφαρμάκου ταμοξιφαίνης στους ενεργούς μεταβολίτες της.[42][43] Στις 18 Οκτωβρίου 2006, η Υποεπιτροπή Κλινικής Φαρμακολογίας συνέστησε την επισήμανση της ταμοξιφαίνης ώστε να περιλαμβάνει πληροφορίες σχετικά με αυτό το γονίδιο στο ένθετο της συσκευασίας.
Ορισμένες παραλλαγές του CYP2D6 σε ασθενείς με καρκίνο του μαστού οδηγούν σε χειρότερη κλινική έκβαση για τη θεραπεία με ταμοξιφαίνη.[44] Ως εκ τούτου, η γονοτύπηση έχει τη δυνατότητα αναγνώρισης των γυναικών που έχουν αυτούς τους φαινοτύπους CYP2D6 και για τις οποίες η χρήση της ταμοξιφαίνης σχετίζεται με κακή έκβαση.
Πρόσφατες μελέτες δείχνουν ότι η λήψη των επιλεκτικών αναστολέων επαναπρόσληψης σεροτονίνης (SSRIs) αντικαταθλιπτικών παροξετίνης (Paxil), φλουοξετίνης (Prozac) και σερτραλίνης (Zoloft) μπορεί να μειώσει την αποτελεσματικότητα της ταμοξιφαίνης, καθώς αυτά τα φάρμακα ανταγωνίζονται για το ένζυμο CYP2D6 που απαιτείται για το μεταβολισμό της ταμοξιφαίνης στις ενεργές μορφές του.[45] Μια μελέτη των ΗΠΑ που παρουσιάστηκε στην ετήσια συνάντηση της Αμερικανικής Εταιρείας Κλινικής Ογκολογίας το 2009 διαπίστωσε ότι μετά από δύο χρόνια, το 7,5% των γυναικών που έλαβαν μόνο ταμοξιφαίνη είχαν υποτροπή, σε σύγκριση με το 16% που έλαβαν παροξετίνη, φλουοξετίνη ή σερτραλίνη, φάρμακα που θεωρούνται aαπό τους πιο ισχυρούς αναστολείς του CYP2D6. Αυτή η διαφορά μεταφράζεται σε αύξηση 120% του κινδύνου υποτροπής του καρκίνου του μαστού. Ασθενείς που λαμβάνουν τα SSRI, όπως Celexa ( σιταλοπράμη ), Lexapro ( εσκιταλοπράμη ) και Luvox (φλουβοξαμίνη), δεν είχαν αυξημένο κίνδυνο επανεμφάνισης, λόγω της έλλειψης ανταγωνιστικού μεταβολισμού για το ένζυμο CYP2D6.[46] Μια νεότερη μελέτη κατέδειξε μια σαφέστερη και ισχυρότερη επίδραση από την παροξετίνη στην πρόκληση των χειρότερων αποτελεσμάτων. Οι ασθενείς που λαμβάνουν θεραπεία με παροξετίνη και ταμοξιφαίνη έχουν 67% αυξημένο κίνδυνο θανάτου από καρκίνο του μαστού, από 24% σε 91%, ανάλογα με τη διάρκεια της συγχορήγησης.[47]
Πρόσφατη έρευνα έδειξε ότι το 7-10% των γυναικών με καρκίνο του μαστού ενδέχεται να μην έχουν το πλήρες ιατρικό όφελος από τη λήψη ταμοξιφαίνης λόγω της γενετικής τους σύνθεσης. Ο έλεγχος DNA για ασφάλεια φαρμάκου μπορεί να εξετάσει τις παραλλαγές του DNA στο CYP2D6 και σε άλλες σημαντικές οδούς επεξεργασίας φαρμάκων. Περισσότερο από το 20% όλων των κλινικά χρησιμοποιούμενων φαρμάκων μεταβολίζονται από το CYP2D6 και γνωρίζοντας την κατάσταση του CYP2D6 ενός ατόμου μπορεί να βοηθήσει τον γιατρό με τη μελλοντική επιλογή φαρμάκων. Μπορούν επίσης να χρησιμοποιηθούν και άλλοι μοριακοί βιοδείκτες για την επιλογή κατάλληλων ασθενών που ενδέχεται να επωφεληθούν από την ταμοξιφαίνη.[48]
Η ταμοξιφαίνη αλληλεπιδρά με ορισμένα άλλα αντιοιστρογόνα.[3] Ο αναστολέας της αρωματάσης αμινογλουτεθυμίδη προκαλεί το μεταβολισμό της ταμοξιφαίνης. Αντίθετα, ο αναστολέας αρωματάσης λετροζόλη δεν επηρεάζει το μεταβολισμό της ταμοξιφαίνης. Ωστόσο, η ταμοξιφαίνη προκαλεί το μεταβολισμό της λετροζόλης και μειώνει σημαντικά τις συγκεντρώσεις της.
Φαρμακολογία[Επεξεργασία | επεξεργασία κώδικα]
Φαρμακοδυναμική[Επεξεργασία | επεξεργασία κώδικα]

Η ταμοξιφαίνη δρα ως εκλεκτικός διαμορφωτής του υποδοχέα οιστρογόνων (SERM) ή ως μερικός αγωνιστής των υποδοχέων οιστρογόνων (ERs). Έχει μικτή οιστρογονική και αντιοιστρογονική δράση, με το προφίλ των επιδράσεων να διαφέρει ανάλογα με τον ιστό. Για παράδειγμα, η ταμοξιφαίνη έχει κατά κύριο λόγο αντιοιστρογονικά αποτελέσματα στο στήθος, αλλά κυρίως οιστρογονικά αποτελέσματα στη μήτρα και στο ήπαρ. Στον ιστό του μαστού, η ταμοξιφαίνη δρα ως ανταγωνιστής ER έτσι ώστε να αναστέλλεται η μεταγραφή γονιδίων που ανταποκρίνονται στα οιστρογόνα.[50]
Η ταμοξιφαίνη έχει σχετικά μικρή συγγένεια για τους ίδιους του ER και αντ 'αυτού δρα ως προφάρμακο ενεργών μεταβολιτών όπως η αφιμοξιφαίνη (4-υδροξυταμοξιφαίνη, 4-ΟΗΤ) και η ενδοξιφαίνη ( Ν -δεμεθυλ-4-υδροξυταμοξιφένη). Αυτοί οι μεταβολίτες έχουν περίπου 30 έως 100 φορές μεγαλύτερη συγγένεια για τους ER ως ταμοξιφαίνη.[51] Η ταμοξιφαίνη έχει 7% και 6% της συγγένειας της οιστραδιόλης για τους ERa και ERβ, αντίστοιχα, ενώ η αφιμοξιφαίνη έχει 178% και 338% της συγγένειας της οιστραδιόλης για τους ERa και ERβ, αντίστοιχα.[52] Ως εκ τούτου, η αφιμοξιφαίνη έχει 25 φορές υψηλότερη συγγένεια για το ERa και 56 φορές υψηλότερη συγγένεια για το ERβ από την ταμοξιφαίνη.[53] Η ταμοξιφαίνη είναι SERM μακράς δράσης, με πυρηνική κατακράτηση του συμπλέγματος ER-ταμοξιφαίνης μεγαλύτερη από 48 ώρες.[54][55]
Η αμοξιφαίνη συνδέεται σε ER, το σύμπλοκο ER/ταμοξιφαίνης στρατολογεί άλλες πρωτεΐνες γνωστές ως συν-καταστολείς, και τα σύμπλοκα στη συνέχεια δεσμεύεται με το DNA και ρυθμίζουν την έκφραση γονιδίου. Μερικές από αυτές τις πρωτεΐνες περιλαμβάνουν της NCoR και SMRT.[56] Η λειτουργία της ταμοξιφαίνης μπορεί να ρυθμιστεί από έναν αριθμό διαφορετικών μεταβλητών, συμπεριλαμβανομένων των αυξητικών παραγόντων.[57] Η ταμοξιφαίνη πρέπει να μπλοκάρει τις πρωτεΐνες του αυξητικού παράγοντα όπως το ErbB2 / HER2[58] επειδή έχει αποδειχθεί ότι υψηλά επίπεδα ErbB2 εμφανίζονται σε καρκίνους ανθεκτικούς στην ταμοξιφαίνη.[59] Η ταμοξιφαίνη φαίνεται να απαιτεί μια πρωτεΐνη PAX2 για την πλήρη αντικαρκινική της δράση.[60] Παρουσία υψηλής έκφρασης PAX2, το σύμπλοκο ταμοξιφαίνης/ER είναι ικανό να καταστέλλει την έκφραση της προ-πολλαπλασιαστικής πρωτεΐνης ERBB2. Αντίθετα, όταν η έκφραση AIB-1 είναι υψηλότερη από το PAX2, το σύμπλοκο ταμοξιφαίνης / ER ρυθμίζει την έκφραση του ERBB2 με αποτέλεσμα τη διέγερση της ανάπτυξης καρκίνου του μαστού.[61]
Η ταμοξιφαίνη έχει βρεθεί ότι μειώνει τα επίπεδα του ινσουλινικού αυξητικού παράγοντα 1 (IGF-1) κατά 17 έως 38% σε γυναίκες και άνδρες.[62] Η καταστολή της παραγωγής IGF-1 στο ήπαρ είναι μια πολύ γνωστή δράση των οιστρογόνων και των SERMs. Μία 10 δόση mg/ημέρα της ταμοξιφαίνης είναι σχεδόν εξίσου αποτελεσματική όσο μία 20 δόση mg / ημέρα για την καταστολή των επιπέδων IGF-1.[3]
Οι επιδράσεις της ταμοξιφαίνης στον καρκίνο του μαστού έκφραση Ki-67, τα επίπεδα σφαιρίνης που δεσμεύει ορμόνη φύλου (SHBG) και τα επίπεδα IGF-1 εξαρτώνται από τη δόση σε εύρος δοσολογίας από ένα έως 20 mg / ημέρα σε γυναίκες με καρκίνο του μαστού.[63]
Η ταμοξιφαίνη είναι αντιγοναδοτροπική σε μετεμμηνοπαυσιακές γυναίκες και καταστέλλει εν μέρει τα επίπεδα των γοναδοτροπινών, της ωχρινοτρόπου ορμόνης (LH) και της ωοθυλακιοτρόπου ορμόνης (FSH) σε τέτοιες γυναίκες. Ωστόσο, έχει προγοναδοτροπικά αποτελέσματα σε προεμμηνοπαυσιακές γυναίκες και αυξάνει τα επίπεδα οιστρογόνων κατά 6 φορές σε αυτές.[64] Λόγω της φύσης της ταμοξιφαίνης ως ανταγωνιστικού προσδέματος ER, αυτή η αύξηση των επιπέδων οιστρογόνων ενδέχεται να επηρεάσει την αντιοιστρογόνο αποτελεσματικότητα της ταμοξιφαίνης.
Άλλες δραστηριότητες[Επεξεργασία | επεξεργασία κώδικα]
Η αφιμοξιφαίνη είναι ένας αγωνιστής του συνζευμένου με πρωτεΐνη G υποδοχέα οιστρογόνων (GPER) με σχετικά χαμηλή συγγένεια (100-1.000 nM, σε σχέση με 3-6 ηΜ για οιστραδιόλη).[65]
Η νορενδοξιφαίνη ( N, N -didesmethyl-4-hydroxytamoxifen), ένας άλλος ενεργός μεταβολίτης της ταμοξιφαίνης, έχει βρεθεί ότι δρα ως ισχυρός ανταγωνιστικός αναστολέας αρωματάσης ( IC <sub id="mwAbw">50</sub> = 90 ηΜ), και μπορεί επίσης να εμπλέκεται στην αντιοιστρογονική δράση της ταμοξιφαίνης.[66]
Εκτός από τη δραστικότητά του ως SERM, η ταμοξιφαίνη είναι ένας ισχυρός και εκλεκτικός αναστολέας πρωτεϊνικής κινάσης C, και είναι δραστικός ως προς αυτό σε θεραπευτικές συγκεντρώσεις.[67] Αυτή η δράση πιστεύεται ότι αποτελεί τη βάση της αποτελεσματικότητας της ταμοξιφαίνης στη θεραπεία της διπολικής διαταραχής.
Η ταμοξιφαίνη είναι ένας αναστολέας της Ρ-γλυκοπρωτεΐνης.
Φαρμακοκινητική[Επεξεργασία | επεξεργασία κώδικα]
Η ταμοξιφαίνη απορροφάται γρήγορα και εκτενώς από τo έντερo μετά από του στόματος χορήγηση.[3][4] Η στοματική βιοδιαθεσιμότητα της ταμοξιφαίνης είναι υψηλή, περίπου στο 100%, γεγονός που υποδηλώνει ελάχιστο μεταβολισμό πρώτης διέλευσης στο έντερο και στο ήπαρ. Μετά την πρόσληψη, τα μέγιστα επίπεδα ταμοξιφαίνης εμφανίζονται μετά από τρεις έως επτά ώρες.[68] Τα επίπεδα ταμοξιφαίνης σε σταθερή κατάσταση επιτυγχάνονται συνήθως μετά από τρεις έως τέσσερις εβδομάδες, αλλά πιθανώς έως και 16 εβδομάδες καθημερινής χορήγησης. Τα επίπεδα της αμιμοξιφαίνης σε σταθερή κατάσταση επιτυγχάνονται μετά το 8 εβδομάδες καθημερινής χορήγησης ταμοξιφαίνης.[69][5]
Ο όγκος κατανομής της ταμοξιφαίνης είναι 50 έως 60 L/kg και η εκκαθάρισή της εκτιμήθηκε από 1,2 έως 5,1 L / ώρα.[3][68] Υψηλές συγκεντρώσεις ταμοξιφαίνης έχουν βρεθεί στον ιστό του μαστού, της μήτρας, του ήπατος, των νεφρών, των πνευμόνων, του παγκρέατος και των ωοθηκών σε ζώα και ανθρώπους. Τα επίπεδα της ταμοξιφαίνης στη μήτρα έχει βρεθεί ότι είναι 2 έως 3 φορές υψηλότερα από ό, τι στην κυκλοφορία. Η δέσμευση της ταμοξιφαίνης και της αμιμοξιφαίνης σε πρωτεΐνες πλάσματος είναι μεγαλύτερη από 99%.[5] Η πλειονότητα της ταμοξιφαίνης συνδέεται με την αλβουμίνη.
Η ίδια η ταμοξιφαίνη είναι ένα προφάρμακο που μεταβολίζεται στο ήπαρ από το κυτόχρωμα Ρ450 και συγκεκριμένα τις ισομορφές CYP3A4, CYP2C9 και CYP2D6 σε δραστικούς μεταβολίτες όπως η αφιμοξιφαίνη και η ενδοξιφαίνη.[3][7] Η ταμοξιφαίνη και οι μεταβολίτες της υφίστανται σύζευξη, συμπεριλαμβανομένης της γλυκουρονιδίωσης και της θείωσης.[69] Η ταμοξιφαίνη μπορεί να αναστέλλει τον μεταβολισμό της.
Η ταμοξιφαίνη έχει μεγάλο χρόνο ημιζωής, συνήθως πέντε έως επτά ημέρες, με εύρος τεσσάρων έως έντεκα ημερών.[3][7][68] Ομοίως, ο χρόνος ημιζωής της αφιμοξιφαίνης είναι 14 μέρες.[5] Αντίθετα, ο χρόνος ημιζωής της ενδοξιφαίνης είναι 50 έως 70 ώρες. Η μεγάλη ημιζωή της ταμοξιφαίνης και της αφιμοξιφαίνης αποδίδονται στην υψηλή πρόσδεση των πρωτεϊνών στο πλάσμα καθώς και στην εντεροηπατική ανακυκλοφορία. Μετά τη διακοπή της θεραπείας, τα επίπεδα της ταμοξιφαίνης και των μεταβολιτών της παραμένουν στην κυκλοφορία για τουλάχιστον 6 εβδομάδες. Η ταμοξιφαίνη απεκκρίνεται στη χολή και αποβάλλεται στα κόπρανα, ενώ μικρές ποσότητες αποβάλλονται στα ούρα.
Παραπομπές[Επεξεργασία | επεξεργασία κώδικα]
- ↑ 1,0 1,1 «Tamoxifen Use During Pregnancy». Drugs.com. 25 Ιουλίου 2019. Ανακτήθηκε στις 27 Ιανουαρίου 2020.
- ↑ «NCI Drug Dictionary». 2 Φεβρουαρίου 2011. Αρχειοθετήθηκε από το πρωτότυπο στις 8 Δεκεμβρίου 2015. Ανακτήθηκε στις 28 Νοεμβρίου 2015.
- ↑ 3,00 3,01 3,02 3,03 3,04 3,05 3,06 3,07 3,08 3,09 «Pharmacokinetics of selective estrogen receptor modulators». Clinical Pharmacokinetics 42 (4): 361–72. 2003. doi:. PMID 12648026.
- ↑ 4,0 4,1 George M. Brenner· Craig Stevens (28 Σεπτεμβρίου 2017). Brenner and Stevens' Pharmacology E-Book. Elsevier Health Sciences. σελίδες 394–. ISBN 978-0-323-39172-6.
- ↑ 5,0 5,1 5,2 5,3 Bruce A. Chabner· Dan L. Longo (7 Δεκεμβρίου 2011). Cancer Chemotherapy and Biotherapy: Principles and Practice. Lippincott Williams & Wilkins. σελίδες 655–. ISBN 978-1-4511-4820-6.
- ↑ 6,0 6,1 6,2 6,3 6,4 6,5 6,6 https://www.accessdata.fda.gov/drugsatfda_docs/label/2002/17970s37s44s49lbl.pdf
- ↑ 7,0 7,1 7,2 7,3 7,4 7,5 7,6 «Clinical pharmacokinetics and pharmacogenetics of tamoxifen and endoxifen». Expert Review of Clinical Pharmacology 12 (6): 523–536. June 2019. doi:. PMID 31008668.
- ↑ «Tamoxifen Citrate». NCI. 26 Αυγούστου 2015. Αρχειοθετήθηκε από το πρωτότυπο στις 4 Ιανουαρίου 2016. Ανακτήθηκε στις 28 Νοεμβρίου 2015.
- ↑ 9,0 9,1 9,2 «Tamoxifen Citrate». The American Society of Health-System Pharmacists. Αρχειοθετήθηκε από το πρωτότυπο στις 4 Ιανουαρίου 2014. Ανακτήθηκε στις 27 Νοεμβρίου 2015.
- ↑ «Selective estrogen receptor modulators». Αρχειοθετήθηκε από το πρωτότυπο στις 9 Δεκεμβρίου 2013. Ανακτήθηκε στις 28 Νοεμβρίου 2015.
- ↑ Selective Estrogen Receptor Modulators a New Brand of Multitarget Drugs. Berlin, Heidelberg: Springer-Verlag Berlin Heidelberg. 2006. σελ. 52. ISBN 9783540347422.
- ↑ «Tamoxifen from Failed Contraceptive Pill to Best-Selling Breast Cancer Medicine: A Case-Study in Pharmaceutical Innovation». Frontiers in Pharmacology 8: 620. 12 Sep 2017. doi:. PMID 28955226.
- ↑ «Tamoxifen (ICI46,474) as a targeted therapy to treat and prevent breast cancer». British Journal of Pharmacology 147 Suppl 1 (Suppl 1): S269-76. January 2006. doi:. PMID 16402113.
- ↑ World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. 2019. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ↑ «The Top 300 of 2020». ClinCalc. Ανακτήθηκε στις 11 Απριλίου 2020.
- ↑ «Tamoxifen Citrate - Drug Usage Statistics». ClinCalc. Αρχειοθετήθηκε από το πρωτότυπο στις 22 Σεπτεμβρίου 2020. Ανακτήθηκε στις 11 Απριλίου 2020.
- ↑ «Modern management of dysmenorrhoea». Trends in Urology, Gynaecology & Sexual Health 14 (5): 25–29. 2009. doi:.
- ↑ «Fourteenth Gaddum Memorial Lecture. A current view of tamoxifen for the treatment and prevention of breast cancer». British Journal of Pharmacology 110 (2): 507–17. October 1993. doi:. PMID 8242225. PMC 2175926. https://archive.org/details/sim_british-journal-of-pharmacology_1993-10_110_2/page/507.
- ↑ «Breast cancer in men». CancerHelp UK. Cancer Research UK. 28 Σεπτεμβρίου 2007. Αρχειοθετήθηκε από το πρωτότυπο στις 1 Δεκεμβρίου 2008. Ανακτήθηκε στις 22 Μαρτίου 2009.
- ↑ Center for Drug Evaluation and Research (7 Ιουλίου 2005). «Tamoxifen Information: reducing the incidence of breast cancer in women at high risk». U.S. Food and Drug Administration. Αρχειοθετήθηκε από το πρωτότυπο στις 19 Ιουνίου 2007. Ανακτήθηκε στις 3 Ιουλίου 2007.
- ↑ «Adjuvant endocrine therapy for women with hormone receptor-positive breast cancer: american society of clinical oncology clinical practice guideline focused update». Journal of Clinical Oncology 32 (21): 2255–69. July 2014. doi:. PMID 24868023.
- ↑ National Cancer Institute (26 Απριλίου 2006). «Study of Tamoxifen and Raloxifene (STAR) Trial». U.S. National Institutes of Health. Αρχειοθετήθηκε από το πρωτότυπο στις 4 Ιουλίου 2007. Ανακτήθηκε στις 3 Ιουλίου 2007.
- ↑ University of Pittsburgh. «STAR Study of Tamoxifen and Raloxifen». Αρχειοθετήθηκε από το πρωτότυπο στις 11 Ιουνίου 2007. Ανακτήθηκε στις 3 Ιουλίου 2007.
- ↑ Dr Susan Love (22 Απριλίου 2006). «Study Finds New Use for Raloxifene: Reducing Breast Cancer in High-Risk Postmenopausal Women». Αρχειοθετήθηκε από το πρωτότυπο στις 2 Αυγούστου 2009. Ανακτήθηκε στις 19 Μαρτίου 2009.
- ↑ «Comparison of tamoxifen and clomiphene citrate for ovulation induction: a meta-analysis». Human Reproduction 20 (6): 1511–5. June 2005. doi:. PMID 15845599. https://archive.org/details/sim_human-reproduction_2005-06_20_6/page/1511.
- ↑ «Revisiting oestrogen antagonists (clomiphene or tamoxifen) as medical empiric therapy for idiopathic male infertility: a meta-analysis». Andrology 1 (5): 749–57. September 2013. doi:. PMID 23970453.
- ↑ «Tamoxifen therapy for the management of pubertal gynecomastia: a systematic review». Journal of Pediatric Endocrinology & Metabolism 26 (9–10): 803–7. 2013. doi:. PMID 23729603.
- ↑ «Prevention of gynecomastia and breast pain caused by androgen deprivation therapy in prostate cancer: tamoxifen or radiotherapy?». International Journal of Radiation Oncology, Biology, Physics 83 (4): e519-24. July 2012. doi:. PMID 22704706.
- ↑ «Treatment of Girls and Boys with McCune-Albright Syndrome with Precocious Puberty - Update 2017». Pediatric Endocrinology Reviews 15 (2): 136–141. December 2017. doi:. PMID 29292624.
- ↑ «Peripheral precocious puberty including congenital adrenal hyperplasia: causes, consequences, management and outcomes». Best Practice & Research. Clinical Endocrinology & Metabolism 33 (3): 101273. April 2019. doi:. PMID 31027974.
- ↑ «Disorders of Puberty: Pharmacotherapeutic Strategies for Management». Handbook of Experimental Pharmacology 261: 507–538. May 2019. doi:. ISBN 978-3-030-50493-9. PMID 31144045.
- ↑ OncoGenetics.Org (Σεπτεμβρίου 2009). «Medications Effective in Reducing Risk of Breast Cancer But Increase Risk of Adverse Effects». OncoGenetics.Org. Αρχειοθετήθηκε από το πρωτότυπο στις 24 Σεπτεμβρίου 2009. Ανακτήθηκε στις 14 Σεπτεμβρίου 2009.
- ↑ «Antagonistic and agonistic effects of tamoxifen: significance in human cancer». Seminars in Oncology 24 (1 Suppl 1): S1-71-S1-80. February 1997. PMID 9045319.
- ↑ «Tamoxifen (TAM): the dispute goes on». Annali dell'Istituto Superiore di Sanita 42 (2): 170–3. 2006. PMID 17033137. Αρχειοθετήθηκε από το πρωτότυπο στις 2007-08-10. https://web.archive.org/web/20070810113431/http://www.iss.it/publ/anna/2006/2/422170.pdf. Ανακτήθηκε στις 2007-07-03.
- ↑ «Tamoxifen for Breast Cancer & Side Effects». Health and Life. 11 Δεκεμβρίου 2009. Αρχειοθετήθηκε από το πρωτότυπο στις 16 Φεβρουαρίου 2010.
- ↑ «Known and Probable Carcinogens». American Cancer Society. 3 Φεβρουαρίου 2006. Αρχειοθετήθηκε από το πρωτότυπο στις 17 Μαρτίου 2008. Ανακτήθηκε στις 21 Μαρτίου 2008.
- ↑ «Comparative assessment of lipid effects of endocrine therapy for breast cancer: implications for cardiovascular disease prevention in postmenopausal women». Breast 15 (3): 301–12. June 2006. doi:. PMID 16230014.
- ↑ «Effect of tamoxifen on venous thromboembolic events in a breast cancer prevention trial». Circulation 111 (5): 650–6. February 2005. doi:. PMID 15699284.
- ↑ «Toremifene: an evaluation of its safety profile». Breast 15 (2): 142–57. April 2006. doi:. PMID 16289904.
- ↑ Ross Cameron· George Feuer (6 Δεκεμβρίου 2012). Drug-Induced Hepatotoxicity. Springer Science & Business Media. σελίδες 565–. ISBN 978-3-642-61013-4.
- ↑ «Tamoxifen-induced non-alcoholic steatohepatitis: where are we now and where are we going?». Expert Opinion on Drug Safety 6 (1): 1–4. January 2007. doi:. PMID 17181445.
- ↑ «Pharmacogenetics of tamoxifen biotransformation is associated with clinical outcomes of efficacy and hot flashes». Journal of Clinical Oncology 23 (36): 9312–8. December 2005. doi:. PMID 16361630.
- ↑ «CYP2D6 polymorphisms and the impact on tamoxifen therapy». Journal of Pharmaceutical Sciences 96 (9): 2224–31. September 2007. doi:. PMID 17518364.
- ↑ «Association between CYP2D6 polymorphisms and outcomes among women with early stage breast cancer treated with tamoxifen». JAMA 302 (13): 1429–36. October 2009. doi:. PMID 19809024.
- ↑ «CYP2D6 genotype, antidepressant use, and tamoxifen metabolism during adjuvant breast cancer treatment». Journal of the National Cancer Institute 97 (1): 30–9. January 2005. doi:. PMID 15632378.
- ↑ Staff Reports (Summer 2009). «ASCO Updates: Antidepressants Reduce the Effectiveness of Tamoxifen.». CURE (Cancer Updates, Research and Education). Αρχειοθετήθηκε από το πρωτότυπο στις 2009-06-22. https://web.archive.org/web/20090622192239/http://www.curetoday.com/index.cfm/fuseaction/article.show/id/2/article_id/1152.
- ↑ «Selective serotonin reuptake inhibitors and breast cancer mortality in women receiving tamoxifen: a population based cohort study». BMJ 340: c693. February 2010. doi:. PMID 20142325.
- ↑ «Tamoxifen in early-stage estrogen receptor-positive breast cancer: overview of clinical use and molecular biomarkers for patient selection». OncoTargets and Therapy 4: 1–11. December 2010. doi:. PMID 21552410.
- ↑ PDB 3ERT; «The structural basis of estrogen receptor/coactivator recognition and the antagonism of this interaction by tamoxifen». Cell 95 (7): 927–37. December 1998. doi:. PMID 9875847.
- ↑ «Identification of estrogen-responsive genes by complementary deoxyribonucleic acid microarray and characterization of a novel early estrogen-induced gene: EEIG1». Molecular Endocrinology 18 (2): 402–11. February 2004. doi:. PMID 14605097.
- ↑ «Endoxifen, a new cornerstone of breast cancer therapy: demonstration of safety, tolerability, and systemic bioavailability in healthy human subjects». Clinical Pharmacology and Therapeutics 88 (6): 814–7. December 2010. doi:. PMID 20981001. https://archive.org/details/sim_clinical-pharmacology-and-therapeutics_2010-12_88_6/page/814.
- ↑ «Pharmacology of estrogens and progestogens: influence of different routes of administration». Climacteric 8 Suppl 1: 3–63. August 2005. doi:. PMID 16112947.
- ↑ «Transdermal drug delivery: clinical considerations for the obstetrician-gynecologist». Obstet Gynecol 105 (5 Pt 1): 953–61. May 2005. doi:. PMID 15863530.
- ↑ Benno Runnebaum· Thomas Rabe (17 Απριλίου 2013). Gynäkologische Endokrinologie und Fortpflanzungsmedizin: Band 1: Gynäkologische Endokrinologie. Springer-Verlag. σελίδες 88–. ISBN 978-3-662-07635-4.
- ↑ Wallach, Edward E.; Hammond, Charles B.; Maxson, Wayne S. (1982). «Current status of estrogen therapy for the menopause». Fertility and Sterility 37 (1): 5–25. doi:. ISSN 0015-0282. PMID 6277697.
- ↑ «Cofactor dynamics and sufficiency in estrogen receptor-regulated transcription». Cell 103 (6): 843–52. December 2000. doi:. PMID 11136970.
- ↑ «Tamoxifen resistance in breast tumors is driven by growth factor receptor signaling with repression of classic estrogen receptor genomic function». Cancer Research 68 (3): 826–33. February 2008. doi:. PMID 18245484.
- ↑ «Regulation of ERBB2 by oestrogen receptor-PAX2 determines response to tamoxifen». Nature 456 (7222): 663–6. December 2008. doi:. PMID 19005469. Bibcode: 2008Natur.456..663H.
- ↑ «Role of the estrogen receptor coactivator AIB1 (SRC-3) and HER-2/neu in tamoxifen resistance in breast cancer». Journal of the National Cancer Institute 95 (5): 353–61. March 2003. doi:. PMID 12618500.
- ↑ «New Mechanism Predicts Tamoxifen Response: PAX2 gene implicated in tamoxifen-induced inhibition of ERBB2/HER2-mediated tumor growth». www.modernmedicine.com. 13 Νοεμβρίου 2008. Αρχειοθετήθηκε από το πρωτότυπο στις 14 Ιουλίου 2011. Ανακτήθηκε στις 14 Νοεμβρίου 2008.
- ↑ «Study sheds new light on tamoxifen resistance». News. CORDIS News. Αρχειοθετήθηκε από το πρωτότυπο στις 20 Φεβρουαρίου 2009. Ανακτήθηκε στις 14 Νοεμβρίου 2008.
- ↑ «Estrogens and selective estrogen receptor modulators in acromegaly». Endocrine 54 (2): 306–314. November 2016. doi:. PMID 27704479.
- ↑ «Selective estrogen-receptor modulators for primary prevention of breast cancer». J. Clin. Oncol. 23 (8): 1644–55. March 2005. doi:. PMID 15755972.
- ↑ «Hormone-related pharmacokinetic variations associated with anti-breast cancer drugs». Expert Opin Drug Metab Toxicol 9 (9): 1085–95. September 2013. doi:. PMID 23687971.
- ↑ «International Union of Basic and Clinical Pharmacology. XCVII. G Protein-Coupled Estrogen Receptor and Its Pharmacologic Modulators». Pharmacol. Rev. 67 (3): 505–40. July 2015. doi:. PMID 26023144.
- ↑ «Inhibition of cytochrome p450 enzymes by the e- and z-isomers of norendoxifen». Drug Metabolism and Disposition 41 (9): 1715–20. September 2013. doi:. PMID 23824607.
- ↑ «Protein kinase C inhibitors: rationale for use and potential in the treatment of bipolar disorder». CNS Drugs 23 (7): 569–82. 2009. doi:. PMID 19552485.
- ↑ 68,0 68,1 68,2 Vincent T. DeVita· Theodore S. Lawrence (18 Μαρτίου 2016). Prostate and Other Genitourinary Cancers: From Cancer: Principles & Practice of Oncology, 10th edition. Wolters Kluwer Health. σελίδες 990–. ISBN 978-1-4963-5421-1.
- ↑ 69,0 69,1 «Pharmacokinetics of anti-cancer drugs used in breast cancer chemotherapy». Advances in Experimental Medicine and Biology 678: 124–32. 2010. doi:. ISBN 978-1-4419-6305-5. PMID 20738014.
