1-μεθυλοκυκλοβουτανόλη
| 1-μεθυλοκυκλοβουτανόλη | |
|---|---|

| |
| Γενικά | |
| Όνομα IUPAC | 1-μεθυλοκυκλοβουτανόλη |
| Άλλες ονομασίες | 1-μεθυλο-1-υδροξυκυκλοβουτάνιο |
| Χημικά αναγνωριστικά | |
| Χημικός τύπος | C5H10O |
| Μοριακή μάζα | 86,13 amu[1] |
| Σύντομος συντακτικός τύπος |
|
| SMILES | OC1(C)CCC1 |
| Δομή | |
| Ισομέρεια | |
| Ισομερή θέσης | 71 |
| Φυσικές ιδιότητες | |
| Χημικές ιδιότητες | |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
Η 1-μεθυλοκυκλοβουτανόλη ή 1-μεθυλο-1-υδροξυκυκλοβουτάνιο είναι ονομασία μιας κυκλοαλκανόλης, δηλαδή κορεσμένης μονοκυκλικής μονοσθενής αλκοόλης. Συνήθως αντιπροσωπεύεται από τον τύπο: ![]() . Με βάση το χημικό της τύπο, C5H10Ο έχει τα ακόλουθα 71 ισομερή:
. Με βάση το χημικό της τύπο, C5H10Ο έχει τα ακόλουθα 71 ισομερή:
- Πεντεν-1-όλη-1 (ελάσσων ταυτομερές της πεντανάλης) με σύντομο συντακτικό τύπο CH3CH2CH2CH=CHOH.
- Πεντεν-2-όλη-1 με σύντομο συντακτικό τύπο CH3CH2CH=CHCH2OH.
- Πεντεν-3-όλη-1 με σύντομο συντακτικό τύπο CH3CH=CHCH2CH2OH.
- Πεντεν-4-όλη-1 με σύντομο συντακτικό τύπο CH2=CHCH2CH2CH2OH.
- Πεντεν-1-όλη-2 (ελάσσων ταυτομερές της πεντανόνης-2) με σύντομο συντακτικό τύπο CH3CH2CH2C(ΟΗ)=CH2.
- Πεντεν-2-όλη-2 (ελάσσων ταυτομερές της πεντανόνης-2) με σύντομο συντακτικό τύπο CH3CH2CH=C(OH)CH3.
- Πεντεν-3-όλη-2 με σύντομο συντακτικό τύπο CH3CH=CHCH(OH)CH3.
- Πεντεν-4-όλη-2 με σύντομο συντακτικό τύπο CH2=CHCH2CH(OH)CH3.
- Πεντεν-1-όλη-3 με σύντομο συντακτικό τύπο CH3CH2CH(OH)CH=CH2.
- Πεντεν-2-όλη-3 (ελάσσων ταυτομερές της πεντανόνης-2) με σύντομο συντακτικό τύπο CH3CH2C(OH)=CHCH3.
- 2-μεθυλοβουτεν-1-όλη-1 (ελάσσων ταυτομερές της [2-μεθυλοβουτανάλης) με σύντομο συντακτικό τύπο CH3CH2C(CH3)=CHOH.
- 3-μεθυλοβουτεν-1-όλη-1 (ελάσσων ταυτομερές της [3-μεθυλοβουτανάλης) με σύντομο συντακτικό τύπο (CH3)2CHCH=CHOH.
- 2-μεθυλοβουτεν-2-όλη-1 με σύντομο συντακτικό τύπο CH3CH=C(CH3)CH2OH.
- 3-μεθυλοβουτεν-2-όλη-1 με σύντομο συντακτικό τύπο (CH3)2C=CHCH2OH.
- 2-μεθυλοβουτεν-3-όλη-1 με σύντομο συντακτικό τύπο CH2=CHCH(CH3)CH2OH.
- 3-μεθυλοβουτεν-3-όλη-1 με σύντομο συντακτικό τύπο CH2=C(CH3)CH2CH2OH.
- Μεθυλοβουτεν-1-όλη-2 (ελάσσων ταυτομερές της [μεθυλοβουτανόνης) με σύντομο συντακτικό τύπο (CH3)2CHC(OH)=CH2.
- Μεθυλοβουτεν-2-όλη-2 (ελάσσων ταυτομερές της [μεθυλοβουτανόνης) με σύντομο συντακτικό τύπο CH2C(CH3)=C(OH)CH3.
- Αιθυλοπροπενόλη με σύντομο συντακτικό τύπο CH2=C(CH2CH3)CH2OH.
- Κυκλοπεντανόλη με σύντομο συντακτικό τύπο
 .
. - 2-μεθυλοκυκλοβουτανόλη με σύντομο συντακτικό τύπο

- 3-μεθυλοκυκλοβουτανόλη με σύντομο συντακτικό τύπο

- κυκλοβουτυλομεθανόλη με σύντομο συντακτικό τύπο

- 1-αιθυλοκυκλοπροπανόλη με σύντομο συντακτικό τύπο

- 2-αιθυλοκυκλοπροπανόλη με σύντομο συντακτικό τύπο

- 1-κυκλοπροπυλοαιθανόλη με σύντομο συντακτικό τύπο

- 2-κυκλοπροπυλοαιθανόλη με σύντομο συντακτικό τύπο

- 1,2-διμεθυλοκυκλοπροπανόλη με σύντομο συντακτικό τύπο

- 2,2-διμεθυλοκυκλοπροπανόλη με σύντομο συντακτικό τύπο

- 2,3-διμεθυλοκυκλοπροπανόλη με σύντομο συντακτικό τύπο

- (1-μεθυλοκυκλοπροπυλο)μεθανόλη με σύντομο συντακτικό τύπο
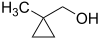
- (2-μεθυλοκυκλοπροπυλο)μεθανόλη με σύντομο συντακτικό τύπο

- Βινυλοπροπυλαιθέρας με σύντομο συντακτικό τύπο CH3CH2CH2OCH=CH2.
- Βινυλισοπροπυλαιθέρας με σύντομο συντακτικό τύπο CH3)2CHOCH=CH2.
- Αιθυλοπροπεν-1-υλαιθέρας με σύντομο συντακτικό τύπο CH3CH=CHOCH2CH3.
- Αιθυλαλλυλυλαιθέρας με σύντομο συντακτικό τύπο CH3=CHCΗ2OCH2CH3.
- Αιθυλο(μεθυλοβινυλ)αιθέρας με σύντομο συντακτικό τύπο CH2=C(CH3)OCH2CH3.
- Βουτεν-1-υλομεθυλαιθέρας με σύντομο συντακτικό τύπο CH3CH2CH=CHOCH3.
- Βουτεν-2-υλομεθυλαιθέρας με σύντομο συντακτικό τύπο CH3CH=CHCH2OCH3.
- Βουτεν-3-υλομεθυλαιθέρας με σύντομο συντακτικό τύπο CH2=CHCH2CH2OCH3.
- Μεθυλο-(1-μεθυλοπροπεν-1-υλ)αιθέρας με σύντομο συντακτικό τύπο CH3CH=C(CH3)OCH3.
- Μεθυλο-(2-μεθυλοπροπεν-1-υλ)αιθέρας με σύντομο συντακτικό τύπο (CH3)2C=CΗOCH3.
- Μεθυλο-(1-μεθυλοπροπεν-2-υλ)αιθέρας με σύντομο συντακτικό τύπο CH2=CHCΗ(CH3)OCH3.
- Μεθυλο-(2-μεθυλοπροπεν-2-υλ)αιθέρας με σύντομο συντακτικό τύπο CH2=C(CH3)CΗ2OCH3.
- (Αιθυλοβινυλ)μεθυλαιθέρας με σύντομο συντακτικό τύπο CH2=C(CΗ2CH3)OCH3.
- Αιθυλοκυκλοπροπυλαιθέρας με σύντομο συντακτικό τύπο

- Κυκλοβουτυλομεθυλαιθέρας με σύντομο συντακτικό τύπο

- Μεθυλο(1-μεθυλοκυκλοπροπυλ)αιθέρας με σύντομο συντακτικό τύπο

- Μεθυλο(2-μεθυλοκυκλοπροπυλ)αιθέρας με σύντομο συντακτικό τύπο

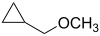
- (Κυκλοπροπυλομεθυλο)μεθυλαιθέρας με σύντομο συντακτικό τύπο
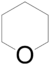
- Οξάνιο με σύντομο συντακτικό τύπο
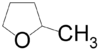
- 2-μεθυλοοξολάνιο με σύντομο συντακτικό τύπο
- 3-μεθυλοοξολάνιο με σύντομο συντακτικό τύπο
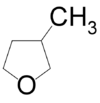
- 2-αιθυλοξετάνιο με σύντομο συντακτικό τύπο
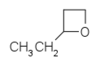
- 3-αιθυλοξετάνιο με σύντομο συντακτικό τύπο

- 2,2-διμεθυλοξετάνιο με σύντομο συντακτικό τύπο

- 2,3-διμεθυλοξετάνιο με σύντομο συντακτικό τύπο

- 2,4-διμεθυλοξετάνιο με σύντομο συντακτικό τύπο

- 3,3-διμεθυλοξετάνιο με σύντομο συντακτικό τύπο

- Προπυλοξιράνιο με σύντομο συντακτικό τύπο

- Ισοροπυλοξιράνιο με σύντομο συντακτικό τύπο
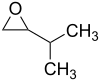
- 2-αιθυλο-2-μεθυλοξιράνιο με σύντομο συντακτικό τύπο

- 2-αιθυλο-3-μεθυλοξιράνιο με σύντομο συντακτικό τύπο
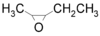
- Τριμεθυλοξιράνιο με σύντομο συντακτικό τύπο

- Πεντανάλη (μείζον ταυτομερές της πεντεν-1-όλης-1) με σύντομο συντακτικό τύπο CH3CH2CH2CH2CHO.
- 2-μεθυλοβουτανάλη (μείζον ταυτομερές της 2-μεθυλοβουτεν-1-όλης-1) με σύντομο συντακτικό τύπο CH3CH2CH(CΗ3 )CHO.
- 3-μεθυλοβουτανάλη (μείζον ταυτομερές της 3-μεθυλοβουτεν-1-όλης-1) με σύντομο συντακτικό τύπο (CH3)2CHCH2CHO.
- Διμεθυλοπροπανάλη με σύντομο συντακτικό τύπο (CH3)3CCHO.
- Πεντανόνη-2 (μείζον ταυτομερές της πεντεν-1-όλης-2 και της πεντεν-2-όλης-2) με σύντομο συντακτικό τύπο CH3CH2CH2COCH3.
- Πεντανόνη-3 (μείζον ταυτομερές της πεντεν-2-όλης-3) με σύντομο συντακτικό τύπο CH3CH2COCH2CH3.
- Μεθυλοβουτανόνη (μείζον ταυτομερές της μεθυλοβουτεν-1-όλης-2 και της μεθυλοβουτεν-2-όλης-2) με σύντομο συντακτικό τύπο (CH3)2CHCOCH2CH3.
Κυκλοβουτάνια[Επεξεργασία | επεξεργασία κώδικα]
«Κυκλοβουτάνια» ονομάζονται τα κυκλοαλκάνια με τετραμελή δακτύλιο, που αποτελεί και το χαρακτηριστικό της δομής τους. Οι πλευρικές αλυσίδες, όταν υπάρχουν, διαμορφώνονται όπως στα αλκάνια. Το ιδιαίτερο χαρακτηριστικό της μοριακής δομής τους είναι η εμφάνιση όχι επίπεδου τετραγώνου, όπως θα περίμενε κανείς, με βάση τα κυκλοπροπάνια, αλλά «πτυχωμένης» (Puckered), όπως αποδείχθηκε από πειράματα περίθλασης ηλεκτρονίων:
Στη δομή αυτή προκύπτουν δυο απέναντι ζεύγη γωνιών που δείνουν μέσο όρο [2], που είναι η συνηθισμένη γωνία δεσμού sp3-sp3 που αντιστοιχεί σε κορεσμένο, οπότε και πάλι προκύπτει «ενέργεια τάσης δεσμών», όπως παραπάνω στα κυκλοπροπάνια, αλλά μικρότερη: Υπολογίστηκε σε ΔQ = 109 kJ/mole[3]. Αποτέλεσμα των παραπάνω είναι τα κυκλοβουτάνια να δείνουν αντιδράσεις προσθηκοδιάσπασης-1,4, αν και χρειάζονται πιο έντονες συνθήκες για να αντιδράσουν και δείνουν μικρότερες αντίστοιχες ταχύτητες αντίδρασης.
Σε σύγκριση με το κυκλοβουτάνιο, η 1-μεθυλοκυκλοβουτανόλη έχει ένα μεθύλιο (CH3) και ένα υδροξύλιο (OH), αντί δύο ατόμων υδρογόνου, ενωμένα στο ίδιο άτομο άνθρακα #1[4].
Παραγωγή[Επεξεργασία | επεξεργασία κώδικα]
Από 1,4-διαλο-2-μεθυλοβουτανόλη-2[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση μετάλλων (συνήθως ψευδάργυρο ή μαγνήσιο) και σε 1,4-διαλο-2-μεθυλοβουτανόλη-2. Π.χ.[5][6]:
- Με μικρή απόδοση.
Από μεθυλοκυκλοβουτάνιο[Επεξεργασία | επεξεργασία κώδικα]
Με οξείδωση μεθυλοκυκλοβουτανίου με υπερμαγγανικό κάλιο παράγεται 1-μεθυλοκυκλοβουτανόλη:
Αναφορές και σημειώσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Ελλείψει άλλης πηγής χρησιμοποιείθηκε η μοριακή μάζα της ισομερούς κυκλοπεντανόλης.
- ↑ Η μικρή αύξηση στην ενέργεια τάσης, σε σχέση με τη δομή τετραγώνου που θα είχε γωνία 90°, αντισταθμίζεαι από μεγαλύτερη ελάττωαη την ενέργεια στρέψης.
- ↑ Ν. Αλεξάνδρου, Γενική Οργανική Χημεία, ΘΕΣΣΑΛΟΝΙΚΗ 1985, σελ. 125-126, §6.1., σελ.128, §6.2.
- ↑ Η αρίθμηση αρχίζει από το άτομο άνθρακα που είναι ενωμένο με το υδροξύλιο
- ↑ G. Gustavson (1887). "Ueber eine neue Darstellungsmethode des Trimethylens". J. Prakt. Chem. 36: 300–305. doi:10.1002/prac.18870360127. http://gallica.bnf.fr/ark:/12148/bpt6k90799n/f308.table.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 154, §6.5.Β1.
Πηγές[Επεξεργασία | επεξεργασία κώδικα]
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Δημήτριου Ν. Νικολαΐδη: Ειδικά μαθήματα Οργανικής Χημείας, Θεσσαλονίκη 1983.
| ||||||||||||||||||||||||||||||||||||||||||||






















