Υπερμαγγανικό ιόν

| |
| |
| Ονόματα | |
|---|---|
| ΣυστηματικήΟνοματολογίαIUPAC
Υπερμαγγανικό | |
| Αναγνωριστικά | |
| 14333-13-2 | |
| ChEBI | CHEBI:25939 |
| ChemSpider | 22811 |
InChI=1S/Mn.4O/q;;;;-1 Key: NPDODHDPVPPRDJ-UHFFFAOYSA-N | |
| Jmol 3Δ Πρότυπο | Image |
| PubChem | 24401 |
[O-] [Mn](=O)(=O)=O | |
| UNII | 2BL953CCZ2 |
CompTox Dashboard (EPA)
|
|
| Ιδιότητες | |
| MnO− 4 | |
| Μοριακή μάζα | 118,93 g·mol−1 |
| ΣυζυγέςΟξύ | Υπερμαγγανικό οξύ |
Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες (25°C, 100 kPa). | |
| Infobox references | |
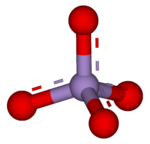
Ένα υπερμαγγανικό ιόν (permanganate) [1] είναι μια χημική ένωση με το ιόν μαγγανίου(VII) MnO−
4, τη συζυγή βάση του υπερμαγγανικού οξέος. Επειδή το άτομο του μαγγανίου έχει αριθμό οξείδωσης +7, το υπερμαγγανικό (VII) ιόν είναι ισχυρό οξειδωτικό μέσο. Το ιόν είναι ένα ιόν μετάλλου μετάπτωσης με τετραεδρική δομή.[2] Τα διαλύματα υπερμαγγανικού έχουν βιολετί χρώμα και είναι σταθερά σε ουδέτερα ή ελαφρώς αλκαλικά μέσα. Η ακριβής χημική αντίδραση εξαρτάται από τα αντιδραστήρια που περιέχουν άνθρακα και από το χρησιμοποιούμενο οξειδωτικό. Για παράδειγμα, το τριχλωροαιθάνιο (C2H3Cl3) οξειδώνεται από υπερμαγγανικά ιόντα για να σχηματίσει διοξείδιο του άνθρακα (CO2), διοξείδιο του μαγγανίου (MnO2), ιόντα υδρογόνου (H+) και ιόντα χλωρίου (Cl−).[3]
- 8MnO−
4 + 3C2H3Cl3 → 6CO2 + 8MnO2 + H+ + 4H2O + 9Cl−
Σε ένα όξινο διάλυμα, το υπερμαγγανικό (VII) ανάγεται στο ανοιχτό ροζ μαγγάνιο(II) (Mn2+) με αριθμό οξείδωσης +2.
- 8 H+ + MnO−
4 + 5 e− → Mn2+ + 4 H2O
Σε ένα ισχυρά βασικό ή αλκαλικό διάλυμα, το υπερμαγγανικό (VII) ανάγεται στο πράσινο μαγγανικό ιόν, MnO2−
4 με αριθμό οξείδωσης +6.
- MnO−
4 + e− → MnO2−
4
Σε ένα ουδέτερο διάλυμα, ωστόσο, ανάγεται στο καφέ διοξείδιο του μαγγανίου MnO2 με αριθμό οξείδωσης +4.
- 2 H2O + MnO−
4 + 3 e− → MnO2 + 4 OH−
Παρασκευή[Επεξεργασία | επεξεργασία κώδικα]
Τα υπερμαγγανικά άλατα μπορούν να παρασκευαστούν με οξείδωση ενώσεων μαγγανίου όπως χλωριούχο μαγγάνιο ή θειικό μαγγάνιο από ισχυρά οξειδωτικά μέσα, για παράδειγμα, υποχλωριώδες νάτριο ή διοξείδιο του μολύβδου:
- 2 MnCl2 + 5 NaClO + 6 NaOH → 2 NaMnO4 + 9 NaCl + 3 H2O
- 2 MnSO4 + 5 PbO2 + 3 H2SO4 → 2 HMnO4 + 5 PbSO4 + 2 H2O
Μπορεί επίσης να παρασκευαστεί από την αυτοοξειδοαναγωγή των μαγγανικών, με το διοξείδιο του μαγγανίου ως παραπροϊόν:
- 3 Na2MnO4 + 2 H2O → 2 NaMnO4 + MnO2 + 4 NaOH
Παρασκευάζονται εμπορικά με ηλεκτρόλυση ή οξείδωση με αέρα αλκαλικών διαλυμάτων μαγγανικών αλάτων (MnO2−
4).[4]

Χρήση[Επεξεργασία | επεξεργασία κώδικα]
Αυτά είναι κοινά και ισχυρά απολυμαντικά, που χρησιμοποιούνται τακτικά στην απολύμανση λουτρών, τουαλετών και νιπτήρων. Είναι μια φθηνή και εξαιρετικά αποτελεσματική ένωση για την εργασία.
Ιδιότητες[Επεξεργασία | επεξεργασία κώδικα]

Τα υπερμαγγανικά (VII) είναι άλατα του υπερμαγγανικού οξέος. Έχουν βαθύ πορφυρό χρώμα, λόγω της μετάβασης μεταφοράς φορτίου από οξο-πρόσδεμα p τροχιακών σε κενά τροχιακά που προέρχονται από τροχιακά d του μαγγανίου(VII) '.[5] Το υπερμαγγανικό (VII) είναι ισχυρό οξειδωτικό μέσο και παρόμοιο με το υπερχλωρικό. Ως εκ τούτου, είναι κοινή χρήση στην ποιοτική ανάλυση που περιλαμβάνει αντιδράσεις οξειδοαναγωγής (υπερμαγγανομετρίας). Σύμφωνα με τη θεωρία, το υπερμαγγανικό είναι αρκετά ισχυρό για να οξειδώσει το νερό, αλλά αυτό στην πραγματικότητα δεν συμβαίνει σε κανένα βαθμό. Εκτός από αυτό, είναι σταθερό. Είναι χρήσιμο αντιδραστήριο, αλλά δεν είναι πολύ επιλεκτικό με οργανικές ενώσεις. Το υπερμαγγανικό κάλιο χρησιμοποιείται ως απολυμαντικό και πρόσθετο επεξεργασίας νερού στην υδατοκαλλιέργεια.[6] Τα μαγγανικά (VII) δεν είναι πολύ σταθερά θερμικά. Για παράδειγμα, το υπερμαγγανικό κάλιο αποσυντίθεται στους 230°C σε μαγγανικό κάλιο και διοξείδιο του μαγγανίου, απελευθερώνοντας αέριο οξυγόνο :
- 2 KMnO4 → K2MnO4 + MnO2 + O2
Τα υπερμαγγανικά μπορούν να οξειδώσουν αμίνες σε μια νιτροενώσεις,[7][8] αλκοόλες σε κετόνες,[9] αλδεΰδες σε καρβοξυλικά οξέα,[10][11] ακραία αλκένια σε καρβοξυλικά οξέα,[12] οξαλικό οξύ σε διοξείδιο του άνθρακα,[13] και αλκένια σε διόλες.[14] Αυτός ο κατάλογος δεν είναι αποκλειστικός. Στις οξειδώσεις αλκενίου ένα ενδιάμεσο είναι ένα κυκλικό είδος Mn(V):[15]
Ασφάλεια[Επεξεργασία | επεξεργασία κώδικα]
Η θανατηφόρα δόση υπερμαγγανικού είναι περίπου 10 g και έχουν συμβεί αρκετές θανατηφόρες δηλητηριάσεις. Η ισχυρή οξειδωτική δράση οδηγεί σε νέκρωση του βλεννογόνου. Για παράδειγμα, ο οισοφάγος επηρεάζεται εάν το υπερμαγγανικό άλας καταποθεί. Μόνο μια περιορισμένη ποσότητα απορροφάται από τα έντερα, αλλά αυτή η μικρή ποσότητα παρουσιάζει σοβαρές επιπτώσεις στα νεφρά και στο συκώτι.[16][17]
Παραπομπές[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Πρότυπο:MW
- ↑ Sukalyan Dash, Sabita Patel; Bijay K. Mishra (2009). «Oxidation by permanganate: synthetic and mechanistic aspects». Tetrahedron 65 (4): 707–739. doi:.
- ↑ «Geo-Cleanse International, INC. | Permanganate».
- ↑ Cotton, F. Albert· Wilkinson, Geoffrey· Carlos A. Murillo· Manfred Bochmann (1999). Advanced Inorganic Chemistry (6th έκδοση). New York: John Wiley & Sons, Inc. σελ. 770. ISBN 978-0471199571.
- ↑ Miessler, Gary L.· Fischer, Paul J.· Tarr, Donald A. (2014). Inorganic Chemistry (5th έκδοση). Pearson. σελ. 430. ISBN 978-0321811059.
- ↑ Syndel. «Potassium Permanganate Sodium Disinfectant».
- ↑ A. Calder, A. R. Forrester1, and S. P. Hepburn (1972), «2-methyl-2-nitrosopropane and its dimer», Org. Synth. 6: 803, http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=CV6P0803; Coll. Vol. 52: 77
- ↑ Nathan Kornblum and Willard J. Jones (1963), «4-nitro-2,2,4-trimethylpentane», Org. Synth. 5: 845, http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=CV5P0845; Coll. Vol. 43: 87
- ↑ J. W. Cornforth (1951), «Ethyl pyruvate», Org. Synth. 4: 467, http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=CV4P0467; Coll. Vol. 31: 59
- ↑ R. L. Shriner and E. C. Kleiderer (1930), «Piperonylic acid», Org. Synth. 2: 538, http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=CV2P0538; Coll. Vol. 10: 82
- ↑ John R. Ruhoff (1936), «n-heptanoic acid», Org. Synth. 2: 315, http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=CV2P0315; Coll. Vol. 16: 39
- ↑ Donald G. Lee, Shannon E. Lamb, and Victor S. Chang (1981), «Carboxylic acids from the oxidation of terminal alkenes by permanganate: nonadecanoic acid», Org. Synth. 7: 397, http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=CV7P0397; Coll. Vol. 60: 11
- ↑ «Revising the Mechanism of the Permanganate/Oxalate Reaction». J. Phys. Chem. A 108 (50): 11026. 2004. doi:. Bibcode: 2004JPCA..10811026K.
- ↑ E. J. Witzemann, Wm. Lloyd Evans, Henry Hass, and E. F. Schroeder (1931), «dl-glyceraldehyde ethyl acetal», Org. Synth. 2: 307, http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=CV2P0307; Coll. Vol. 11: 52
- ↑ Lee, Donald G.; Chen, Tao (1993), «Reduction of manganate(VI) by mandelic acid and its significance for development of a general mechanism of oxidation of organic compounds by high-valent transition metal oxides», J. Am. Chem. Soc. 115 (24): 11231–36, doi:.
- ↑ Ong, K. L.; Tan, T. H.; Cheung, W. L. (1997). «Potassium permanganate poisoning – a rare cause of fatal self poisoning». Emergency Medicine Journal 14 (1): 43–45. doi:. PMID 9023625.
- ↑ Young, R.; Critchley, J. A.; Young, K. K.; Freebairn, R. C.; Reynolds, A. P.; Lolin, Y. I. (1996). «Fatal acute hepatorenal failure following potassium permanganate ingestion». Human & Experimental Toxicology 15 (3): 259–61. doi:. PMID 8839216. https://archive.org/details/sim_human-and-experimental-toxicology_1996-03_15_3/page/259.

