Υδρόθειο
| Υδρόθειο | |||
|---|---|---|---|

| |||

| |||
| |||
| Γενικά | |||
| Όνομα IUPAC | Υδροσουλφίδιο | ||
| Άλλες ονομασίες | Υδρόθειο Σουλφίδιο του υδρογόνου Θειάνιο Σουλφάνιο Αέριο υπονόμων Υδρομονοσουλφίδιο Διυδροσουλφίδιο Θειούχο υδρογόνο Υδρίδιο του θείου Υδροθειικό οξύ Υδροσουλφουρικό οξύ Υδροθειονικό οξύ Θειυδροξικό οξύ Θειυδρικό οξύ Σουλφυδρικό οξύ | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | H2S | ||
| Μοριακή μάζα | 34,081 ± 0,005 amu | ||
| Αριθμός CAS | 7783-06-4 | ||
| SMILES | S | ||
| Αριθμός EINECS | 231-977-3 | ||
| Αριθμός RTECS | MX1225000 | ||
| Αριθμός UN | 1053 | ||
| PubChem CID | 402 | ||
| ChemSpider ID | 391 | ||
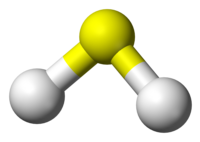
| Δομή | |||
| Διπολική ροπή | 0,97 D | ||
| Μήκος δεσμού | 133,6 pm | ||
| Είδος δεσμού | ομοιοπολικός σ (1s-3sp3) | ||
| Πόλωση δεσμού | 3,6% (H+-S-) | ||
| Γωνία δεσμού | 92,1° | ||
| Μοριακή γεωμετρία | επίπεδη γωνιακή | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -82,30 °C | ||
| Σημείο βρασμού | -60.28 °C | ||
| Κρίσιμη θερμοκρασία | 100,4 °C | ||
| Κρίσιμη πίεση | 88,9 atm | ||
| Πυκνότητα | 1,363 kg/m³ | ||
| Διαλυτότητα στο νερό |
4 kg/m³ (20 °C) | ||
| Δείκτης διάθλασης , nD |
1,000644 (0 °C) | ||
| Τάση ατμών | 1.740 kPa (21 °C) | ||
| Εμφάνιση | Άχρωμο αέριο Οσμή κλούβιου αβγού | ||
| Χημικές ιδιότητες | |||
| pKa | 6,8919 11,96 | ||
| Ελάχιστη θερμοκρασία ανάφλεξης |
-82,4 °C | ||
| Σημείο αυτανάφλεξης | 232 °C | ||
| Επικινδυνότητα | |||
  
| |||
| Πολύ εύφλεκτο (F+) Πολύ τοξικό (T+) Επικίνδυνο για το περιβάλλον(N) | |||
| Φράσεις κινδύνου | 12, 26, 50 | ||
| Φράσεις ασφαλείας | 1/2, 9, 16, 36, 38, 45, 61 | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το υδρόθειο[1] (αγγλικά ΗΠΑ hydrogen sulfide[2] και αγγλικά Ηνωμένου Βασιλείου hydrogen sulphide) είναι ανόργανη δυαδική[3] χημική ένωση με μοριακό τύπο H2S. Ανήκει στα υδροχαλκογόνα, μαζί με το νερό (H2O), το υδροσελήνιο (H2Se), το υδροτελλούριο (H2Te) και το υδρίδιο του πολωνίου (PoH2).
Το χημικά καθαρό υδρόθειο, στις κανονικές συνθήκες περιβάλλοντος, δηλαδή σε θερμοκρασία 25°C και υπό πίεση 1 atm, είναι άχρωμο αέριο, με τη χαρακτηριστική οσμή των κλούβιων αυγών. Είναι βαρύτερο από τον αέρα, πολύ δηλητηριώδες, διαβρωτικό, εύφλεκτο και εκρηκτικό. Είναι συχνά το αποτέλεσμα της αναερόβιας βακτηριδιακής αποικοδόμησης (διαφόρων) θειούχων οργανικών ουσιών, σε έλη και αποχετεύσεις. Αυτή η διεργασία είναι συχνά γνωστή ως αναερόβια πέψη (anaerobic digestion). Το υδρόθειο βρίσκεται, επίσης, στα ηφαιστειακά αέρια, στο φυσικό αέριο και στο νερό κάποιων πηγαδιών. Είναι ακόμα παρόν σε πετρώδη άλατα τύπου αλίτη, με πιο αξιοσημείωτη περίπτωση αυτά του Μαύρου Αλατιού των Ιμαλαΐων, που είναι μια «αλατώδης οροσειρά» ("Salt Range" mountains) στο Πακιστάν, αυτή με τη μεγαλύτερη εκμετάλλευση, για τον ορυκτό πλούτο που περιέχει. Το ανθρώπινο σώμα επίσης παράγει μικρές ποσότητες υδροθείου και το χρησιμοποιεί ως χημικό μήνυμα. Διαλυμένο στο νερό, το υδρόθειο είναι γνωστό ως «υδροθειικό οξύ» ή «θειυδρικό οξύ» (hydrosulfuric acid ή sulfhydric acid), ένα ασθενές οξύ.
Ο Σουηδός χημικός Καρλ Γουΐλχελμ Σέελε (Carl Wilhelm Scheele) πιστώθηκε την ανακάλυψη του υδρόθειου, το 1777.
Το 2015, βρέθηκε ότι το υδρόθειο υπό υψηλή πίεση (150 GPa) μπορεί να γίνει υπεραγωγός στους 190 K, κατέχοντας έτσι την υψηλότερη γνωστή ως σήμερα θερμοκρασία στην οποία υφίσταται το φαινόμενο της υπεραγωγιμότητας[4].
Σημειώνεται ότι δυο πρωτεϊνικά αμινοξέα, η κυστεΐνη και η μεθειονίνη περιέχουν θείο.
Φυσική παρουσία[Επεξεργασία | επεξεργασία κώδικα]

Μικρές ποσότητες υδροθείου βρίσκονται στο αργό πετρέλαιο και στο φυσικό αέριο. Ιδιαίτερα το τελευταίο μπορεί να περιέχει υδρόθειο σε περιεκτικότητα ως και 90%[5]. Τα ηφαίστεια και κάποιες μεταλλικές πηγές, τόσο θερμές όσο και ψυχρές, εκλύουν επίσης κάποιες ποσότητες υδροθείου, πιθανότατα ως προϊόν υδρόλυσης κάποιων θειούχων ορυκτών:
Το υδρόθειο μπορεί να βρίσκεται στο πηγαδίσιο νερό, συχνά ως αποτέλεσμα δράσης βακτηρίων που ανάγουν θειικά ιόντα. Σε τέτοιες περιπτώσεις, συχνά χρησιμοποιείται όζον (O3) για την απομάκρυνσή του. Μια εναλλακτική μέθοδος είναι η χρήση φίλτρου με διοξείδιο του μαγγανίου (MnO2). Και οι δυο μέθοδοι οξειδώνουν το υδρόθειο σε λιγότερο τοξικά θειικά παράγωγα.
Το υδρόθειο παράγεται από το ανθρώπινο σώμα σε μικρές δόσεις, μέσω εντερικής βακτηριακής αποσύνθεσης θειούχων πρωτεϊνών, αλλά επίσης παράγεται στο στόμα και είναι η αιτία για το πρόβλημα της δυσοσμίας του στόματος. [7]
Ένα (άγνωστο) ποσοστό των συνολικών παγκόσμιων εκπομπών υδροθείου είναι ανθρωπογενούς προέλευσης. Κυριότερη αιτία γι' αυτό είναι τα διυλιστήρια, τα οποία αποθειώνουν κάποια θειούχα συστατικά του αργού πετρελαίου, (καταλυτικά) με τη χρήση υδρογόνου, οπότε το αποτέλεσμα είναι η παραγωγή υδροθείου με αναγωγή, μέσω της διεργασίας Κλάους (Claus process), που είναι πλέον και η κύρια (σύγχρονη) πηγή παραγωγής στοιχειακού θείου. Άλλες ανθρωπογενείς πηγές που εκλύουν υδρόθειο είναι οι υψικάμινοι ορυκτού άνθρακα (συνήθως συμπεριέχει και θείο), οι χαρτοβιομηχανίες (χρησιμοποιούν τη μέθοδο των θειικών) και τα βυρσοδεψεία. Γενικά, εκλύεται υδρόθειο, οπουδήποτε στοιχειακό θείο έρχεται σε επαφή με οργανικό υλικό, ιδιαίτερα σε υψηλές θερμοκρασίες. Το φαινόμενο αυτό, που εξαρτάται από τις περιβαλλοντικές συνθήκες, είναι υπεύθυνο για την αλλοίωση (οργανικού) υλικού μέσω της δράσης κάποιων μικροοργανισμών που οξειδώνουν θείο. Ονομάζεται «βιογενική διάβρωση θειούχων» (biogenic sulfide corrosion).
Το 2011 αναφέρθηκε αυξημένη συγκέντρωση υδροθείου, πιθανώς εξαιτίας πρακτικών εκμετάλλευσης κοιτασμάτων πετρελαίου, που παρατηρήθηκε στο κοίτασμα του αργού (πετρελαίου) Bakken (Bakken formation crude), και παρουσιάστηκαν προκλήσεις στους «υγειονομικούς και περιβαλλοντικούς κινδύνους, διάβρωση της γεωτρήσεως, προστιθέμενο κόστος σχετικό με το χειρισμό των υλικών και του εξοπλισμού του αγωγού, και επιπλέον απαιτήσεις (κόστους) διύλισης»[8].
Εκτός από τους εργαζόμενους και τους κατοίκους που κατοικούν κοντά σε κοιτάσματα πετρελαίου ή φυσικού αερίου, οι υπόλοιποι κάτοικοι μπορούν, επίσης, να εκτεθούν στο υδρόθειο αν κατοικούν κοντά σε εγκαταστάσεις επεξεργασίας αποβλήτων, χωματερές και αγροτικές καλλιέργειες με χώρους αποθήκευσης κοπριάς. Η έκθεση σε υδρόθειο μπορεί να συμβεί μέσω της εισπνοής αέρα που περιέχει αέριο υδρόθειο, ή πίνοντας νερό που το περιέχει σε διάλυση[9].
Στις αστικές χωματερές, η ταφή οργανικής ύλης γρήγορα οδηγεί στην παραγωγή αναερόβιας πέψης μέσα στη μάζα των αποβλήτων, με την επίδραση υγρασίας της ατμόσφαιρας, σε συνδυασμό με τη σχετικά υψηλή θερμοκρασία, που συνοδεύει τη βιοαποικοδόμησης, παράγεται βιοαέριο μόλις ο αέρας μέσα σε αυτήν (τη μάζα των αποβλήτων που ανάγεται). Αν υπάρχει πηγή θειικών στο υλικό αυτό, όπως γυψοσανίδες ή φυσικός γύψος (διένυδρο θειικό ασβέστιο), υπό αναερόβιες συνθήκες, τα βακτήρια ανάγουν τα θειικά αυτά σε υδρόθειο. Αυτά τα βακτήρια δεν μπορούν δεν μπορούν να επιβιώσουν στον αέρα, παρά μόνο στις υγρές, θερμές, αναερόβιες συνθήκες των θαμμένων αποβλήτων που περιέχουν υψηλή συγκέντρωση άνθρακα, που αποτελούν ιδανικό περιβάλλον για το σχηματισμό υδροθείου. Σε χωματερές «αδρανών υλικών», το χαρτί και η κόλλα που χρησιμοποιείται στη βιομηχανοποίηση τέτοιων υλικών όπως οι γυψοσανίδες μπορούν να παρέχουν μια πλούσια πηγή άνθρακα.[10]
Στη βιομηχανική διεργασία αναερόβιας πέψης, τέτοια διαχείριση υγρών αποβλήτων ή η πέψη οργανικών αποβλήτων από τη γεωργία, το υδρόθειο μπορεί να σχηματιστεί από την αναγωγή τόσο θειικών, όσο και από την αποικοδόμηση αμινοξέων και πρωτεϊνών μέσα σε αυτά οργανικά υλικά.[11] Τα θειικά είναι σχετικά μη συμβατά με τα μεθανοποιητικά βακτήρια, αλλά μπορούν να αναχθούν σε υδρόθειο από τα θειοαναγωγικά βακτήρια, από τα οποία υπάρχουν αρκετά γένη.[12]
Παραγωγή[Επεξεργασία | επεξεργασία κώδικα]
Το υδρόθειο συνήθως λαμβάνεται με απομόνωσή του από κοιτάσματα όξινου φυσικού αερίου, μια ποικιλία φυσικού αερίου με σημαντική (πάνω από 5,7 mg/m³ ή 4 ppm) περιεκτικότητα σε υδρόθειο. Μπορεί επίσης να παραχθεί με επίδραση υδρογόνου σε τηγμένο θείο (ολική σύνθεση):
Ακόμη, ιδιαίτερα μεγάλες ποσότητες υδρόθειου λαμβάνονται κατά τη διαδικασία της αποθείωσης του πετρελαίου. Περίπου 68·106 μετρικοί τόνοι υδρόθειου παράγονται κάθε χρόνο[13], στη συντριπτική τους ποσότητα ως παραπροϊόν της αποθείωσης του πετρελαίου (του οποίου η παραγωγή είναι περίπου 3,9·109 μετρικοί τόνοι το χρόνο[14]). Αυτό συμβαίνει διότι ενώ η μέση περιεκτικότητα του αργού πετρελαίου σε θειάφι είναι συνήθως πολύ μικρή (<0.02%), περιβαλλοντικοί κανονισμοί σχετικά με τα καύσιμα και τις εκπομπές ρύπων στις αναπτυγμένες χώρες κάνουν υποχρεωτική την εκμηδένιση της σε ποσά λίγων ppm.
Επίσης, κάποια βακτήρια μπορούν να χρησιμοποιούν θειικά άλατα (αντί για στοιχειακό οξυγόνο) ως οξειδωτικό, για να οξειδώνουν οργανικές ύλες και να παράγουν (έτσι) χρήσιμη (γι' αυτά) ενέργεια, κάτω από συνθήκες χαμηλής συγκέντρωσης σε μοριακό οξυγόνο. Το υδρόθειο παράγεται ως παραπροϊόν του παραπάνω αναφερόμενου αναερόβιου καταβολισμού.
Οι συνηθισμένες μέθοδοι εργαστηριακής παραγωγής υδροθείου είναι οι ακόλουθες:
1. Με επίδραση αραιού υδροχλωρικού οξέος (HCl), σε θειούχο σίδηρο (FeS):
2. Για καθαρότερη, όμως, λήψη υδρόθειου χρησιμοποιείται περισσότερο το θειούχο αντιμόνιο (Sb2S3) αντί του FeS:
3. Με υδρόλυση θειούχου αργιλίου (Al2S3):
Ακόμη, το υδρόθειο μπορεί να παραχθεί με τη θέρμανση στοιχειακού θείου μαζί με στερεές οργανικές ενώσεις, αλλά και ανάγοντας θειούχες οργανικές ενώσεις με υδρογόνο. Π.χ.[15]:
Οι συσκευές θέρμανσης νερού μπορούν να βοηθήσουν τη μετατροπή τυχόν διαλυμένων στο νερό θειικών ιόντων σε υδρόθειο. Η βοήθεια της θέρμανσης βρίσκεται στην παροχή θερμού περιβάλλοντος που ευνοεί θειοβακτήρια να καταλύουν την αντίδραση αναγωγής θειικών ιόντων σε υδρόθειο, αλλά και ενισχύοντας την αντίδραση αλληλεπίδρασης ανάμεσα στα θειικά ιόντα του νερού και της ανόδου του ηλεκτρικού θερμαντήρα, γιατί η τελευταία (άνοδος) συνήθως είναι κατασκευαμένη από μεταλλικό μαγνήσιο, που ανάγει τα θειικά ιόντα σε υδρόθειο.
Το υδρόθειο είναι επίσης παραπροϊόν διαφόρων αντιδράσεων με διαφορετικό στόχο και γι' αυτό, όταν υπάρχει αυτός ο κίνδυνος, πρέπει να παίρνονται οι ανάλογες προφυλάξεις, γιατί η έκθεση προσωπικού σ' αυτό μπορεί να αποδειχθεί μοιραία.
Ιδιότητες[Επεξεργασία | επεξεργασία κώδικα]
Το υδρόθειο, στις συνηθισμένες συνθήκες, είναι αέριο άχρωμο με δυσάρεστη οσμή. Υγροποιείται στους -60 °C και στερεοποιείται στους -80 °C. Επίσης και υπό πίεση 17 atm είναι δυνατή η υγροποίησή του και στους 18 °C. Είναι διαλυτό στο νερό και στην αιθυλική αλκοόλη.
Το υδρόθειο είναι λίγο βαρύτερο από τον ατμοσφαιρικό αέρα (μοριακή μάζα υδροθείου = 34,082 amu έναντι μέσης μοριακής μάζας ατμοσφαιρικού αέρα ~28,8 amu). Ένα μείγμα υδροθείου - αέρα μπορεί να είναι εκρηκτικό. Το υδρόθειο καίγεται με το οξυγόνο, δίνοντας γαλάζια φλόγα και σχηματίζοντας διοξείδιο του θείου (SO2) και νερό:
Γενικά δρα σαν ένα αναγωγικό αντιδραστήριο. Σε υψηλή θερμοκρασία ή με παρουσία καταλυτών ανάγει το διοξείδιο του θείου σχηματίζοντας στοιχειακό θείο και νερό:
Αυτό είναι εκμεταλλεύσιμο στη μέθοδο Clauss, που είναι η κύρια μέθοδος μετατροπής υδροθείου (και ομοίως θειολών) σε στοιχειακό θείο[16]:
Το υδρόθειο είναι λίγο διαλυτό στο νερό και δρα σαν ασθενές διπρωτικό οξύ με pKa1 = 6,9[17], δίνοντας αρχικά HS-, και pKa2 = 11,96, δίνοντας S2-, ένα ανιόν που υπάρχει μόνο σε πολύ αλκαλικά υδατικά διαλύματα. Αντιδρά με τα καυστικά αλκάλια σχηματίζοντας δύο σειρές αλάτων, τα «όξινα» και τα «ουδέτερα» θειούχα άλατα, όπως π.χ. το όξινο θειούχο νάτριο (NaHS) και το (ουδέτερο) θειούχο νάτριο (Na2S):
Αρχικά το διάλυμα υδροθείου στο νερό είναι διαυγές, αλλά γίνεται σταδιακά θολό, εξαιτίας της αντίδρασής του με το επίσης διαλυμένο στο νερό οξυγόνο, παράγοντας στοιχειακό θείο, που αρχικά θολώνει το νερό και μετά καθιζάνει αργά:
Ακόμη, με μερικά κατιόντα μετάλλων σχηματίζει συνήθως σκούρα δυσδιάλυτα θειούχα άλατα που καθιζάνουν. Για παράδειγμα με οξικό μόλυβδο [(CH3COO)2Pb] σχηματίζει δυσδιάλυτο θειούχο μόλυβδο:
Η παραπάνω αντίδραση αποτελεί και μια μέθοδο ποιοτικής ανίχνευσης υδροθείου και γενικότερα θειούχων ιόντων, αλλά και των μετάλλων και μεταλλοειδών που καταβυθίζει. Χαρτί εμποτισμένο σε οξικό μόλυβδο χρησιμοποιείται για την ανίχνευση υδρόθειου, επειδή όταν έρχεται σε επαφή με το τελευταίο γίνεται γκρι, λόγω παραγωγής θειούχου μολύβδου. Η επίδραση ενός ισχυρού οξέος σε θειούχα μέταλλα απελευθερώνει υδρόθειο. Αν αέριο υδρόθειο έρθει σε επαφή με πυκνό νιτρικό οξύ έχουμε έκρηξη. Κατά την έκρηξη αυτή συμπαράγονται οξείδια του αζώτου (NOx), οξείδια του θείου (SOx) και υδρατμοί.
Το υδρόθειο αντιδρά με τις αλκοόλες (ROH) σχηματίζοντας τις αντίστοιχες θειόλες (RSH)[18]::
Σε υψηλές πιέσεις, πάνω από 90 GPa, το υδρόθειο γίνεται αγωγός του ηλεκτρισμού. Όταν ψυχθεί, σε αυτήν τη φάση υψηλής πίεσης εμφανίζει υπεραγωγιμότητα. Η υπεραγώγιμη κρίσιμη θερμοκρασία της ένωσης αυξάνεται με την πίεση, έχοντας τιμή 23 K, υπό πίεση 100 GPa, και φθάνοντας τους 150 K, υπό πίεση 200 GPa. Αν το υδρόθειο πιεστεί σε υψηλότερες θερμοκρασίες και στη συνέχεια ψυχθεί, η υπεραγώγιμη κρίσιμη θερμοκρασία του φθάνει ως τους 190 K, που είναι η υψηλότερη αποδεκτή υπεραγώγιμη κρίσιμη θερμοκρασία, τουλάχιστον ως το 2015[4]. Με αντικατάσταση μικρού ποσοστού θείου με φωσφόρο (σχηματίζοντας δηλαδή λίγη φωσφίνη) και εξασκώντας ακόμη υψηλότερες πιέσεις, έχει προβλεφθεί ότι είναι πιθανό να αυξηθεί η υπεραγώγιμη κρίσιμη θερμοκρασία πάνω από τους 0 °C, επιτυγχάνοντας ακόμη και υπεραγωγιμότητα θερμοκρασίας δωματίου (20 °C).[19]
Εφαρμογές[Επεξεργασία | επεξεργασία κώδικα]
Παραγωγή θείου, θειούχων οργανικών ενώσεων, θειούχων αλκαλιμετάλλων και εφαρμογές σε άλλες βιομηχανίες[Επεξεργασία | επεξεργασία κώδικα]
Η κυριότερη εφαρμογή του υδροθείου είναι ως πρόδρομη ένωση για την παραγωγή (χημικά καθαρού) στοιχειακού θείου. Ακόμη, όμως, αρκετές θειούχες οργανικές ενώσεις παράγονται με τη χρήση υδροθείου. Αυτές περιλαμβάνουν τη μεθανοθειόλη (CH3SH), την αιθανοθειόλη (C2H5SH) και το υδροθειαιθανικό οξύ (HSCH2COOH).[20]
Με την επίδραση βάσεων αλκαλιμετάλλων, το υδρόθειο μετατρέπεται στα αντίστοιχα όξινα ή και ουδέτερα θειικά άλατα, όπως το όξινο θειικό νάτριο και το θειούχο νάτριο, αντιστοίχως:
Αυτές οι ενώσεις αξιοποιούνται από τις χαρτοποιίες. Ειδικότερα, όξινα θειούχα άλατα (που περιέχουν ιόντα SH-) διασπούν δεσμούς ανάμεσα στη λιγνίνη και στην κυτταρίνη, που είναι συστατικά του χαρτοπολτού, σύμφωνα με τη μέθοδο Κραφτ.[21]
Η αποτρίχωση των δερμάτων για την παραγωγή δερμάτινων προϊόντων γίνεται με εφαρμογή της ομώνυμης μεθόδου.
Στην Αναλυτική Χημεία[Επεξεργασία | επεξεργασία κώδικα]
Το υδρόθειο ήταν σημαντικό αναλυτικό αντιδραστήριο για πάνω από έναν αιώνα στην ανόργανη ποιοτική αανάλυση των ιόντων μετάλλων και μεταλλοειδών. Η ομώνυμη μέθοδος (μέθοδος υδροθείου) αξιοποιούσε το υδρόθειο για την καταβύθιση των ιόντων μολύβδου (Pb2+), χαλκού (Cu2+), υδραργύρου (Hg2+) και αρσενικού (As3+) με τη μορφή των αντίστοιχων δυσδιάλυτων θειούχων αλάτων, για το διαχωρισμό τους από άλλα που σχηματίζουν ευδιάλυτα θειούχα άλατα.
Παραγωγή άλλων θειούχων ενώσεων μετάλλων[Επεξεργασία | επεξεργασία κώδικα]
Τα περισσότερα μέταλλα και μεταλλοειδή σχηματίζουν αντίστοιχα θειούχα προϊόντα. Αυτό είναι πλατιά εκμεταλλεύσιμο. Αέρια, υγρά ή διαλύματα που περιέχουν ανεπιθύμητα μέταλλα μπορούν να καθαριστούν με τη χρήση υδροθείου, που καταβυθίζει πολλά από αυτά. Αξιοποιείται ακόμη στον καθαρισμό ορυκτών μεταλλευμάτων. Μεταλλικά εξαρτήματα συχνά επιδρούνται με υδρόθειο για να σχηματίσουν, για προστασία τους, επιφανειακά στρώματα των αντίστοιχων θειούχων ενώσεων. Μερικοί μεταλλικοί καταλύτες ενεργοποιούνται με τη χρήση υδροθείου.
Διάφορες άλλες εφαρμογές[Επεξεργασία | επεξεργασία κώδικα]
Το υδρόθειο χρησιμοποιήθηκε επίσης για το διαχωρισμό του βαρέως ύδατος (D2O) από το κοινό, μέσω της διεργασίας Girdler Sulfide.
Μεταλλικά νερά που περιέχουν υδρόθειο θεωρούνται θεραπευτικά σε πολλές νόσους του αναπνευστικού συστήματος. Επίσης εισπνεόμενα ίχνη ατμών του διεγείρουν το αναπνευστικό σύστημα. Πολλά παράγωγα του υδροθείου είναι πολυθειούχες ενώσεις, (τα μόρια των οποίων περιλαμβάνουν αλυσίδες δύο ή περισσοτέρων ατόμων του θείου), που παρασκευάζονται με διάφορους τρόπους.
Επιστήμονες από το Πανεπιστήμιο του Έξετερ (University of Exeter) ανακάλυψαν ότι η έκθεση κυττάρων σε μικρές ποσότητες υδροθείου μπορεί να εμποδίσει τη μιτοχονδριακή βλάβη. Αυτή η μελέτη θα μπορούσε να έχει περαιτέρω συνέπειες για την πρόληψη των εγκεφαλικών επεισοδίων, της καρδιακής νόσου και την αρθρίτιδα[22].
Ομοίως, μικρές ποσότητες υδρόθειου μπορεί να έχουν αντιγηραντικές ιδιότητες, μπλοκάροντας τη δράση καταστροφικών χημικών μέσα στα κύτταρα, έχοντας παρόμοιες ιδιότητες με την ρεσβερατρόλη, ένα αντιοξειδωτικό που βρίσκεται στο κόκκινο κρασί[23].
Αφαίρεση από καύσιμα[Επεξεργασία | επεξεργασία κώδικα]
Το υδρόθειο συχνά βρίσκεται στο φυσικό αέριο, στο βιοαέριο και στο υγραέριο. Μπορεί να αφαιρεθεί με έναν αριθμό τρόπων:
Αντίδραση με τριοξείδιο του σιδήρου[Επεξεργασία | επεξεργασία κώδικα]
Το αέριο από το οποίο είναι επιθυμητή η αφαίρεση υδροθείου αντλείται σε ένα δοχείο που περιέχει ένυδρο τριοξειδίου του σιδήρου, το οποίο αντιδρώντας με το υδρόθειο παράγει τριθειούχο σίδηρο:
Αν είναι επιθυμητό να αναγεννήσουμε το τριοξείδιο του σιδήρου για νέα χρήση, το δοχείο πλημμυρίζεται με νερό και φυσαλίδες αέρα. Τότε ο τριθειούχος σίδηρος, που παράχθηκε με την παραπάνω αντίδραση, οξειδώνεται ξανασχηματίζοντας το τριοξείδιο του σιδήρου, ενώ αποβάλλεται και στοιχειακό θείο:
Με την ολοκλήρωση της παραπάνω αναγεννητικής αντίδρασης, το δοχείο αδιάζεται από το νερό και μπορεί να ξαναχρησιμοποιηθεί ομοίως.
Το πλεονέκτημα αυτού του συστήματος είναι ότι είναι τελείως παθητικό κατά τη διάρκεια της φάσης της αφαίρεσης[24].
Υδροαποθείωση[Επεξεργασία | επεξεργασία κώδικα]
Κύριο άρθρο υδροαποθείωση.
Η υδροαποθείωση είναι μια πιο πολύπλοκη μέθοδος για την αφαίρεση θείου από θειούχα καύσιμα, με σκοπό τη μείωση των εκπομπών διοξειδίου του θείου, που αποτελούν παράγοντα πρόκλησης για περιβαλλοντικά προβλήματα, όπως η όξινη βροχή και το νέφος αιθαλομίχλης.
Παραπομπές και σημειώσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Για εναλλακτικές ονομασίες δείτε τον πίνακα πληροφοριών.
- ↑ "Hydrogen Sulfide - PubChem Public Chemical Database". The PubChem Project. USA: National Center for Biotechnology Information.
- ↑ Σημείωση: Ένωση που περιέχει δύο (2) μόνο χημικά στοιχεία.
- ↑ 4,0 4,1 Drozdov, A.; Eremets, M. I.; Troyan, I. A. (2014). "Conventional superconductivity at 190 K at high pressures" (PDF). arxiv 1412: 460. arXiv:1412.0460v1. Bibcode:2014arXiv1412.0460D. Retrieved 1 September 2014.
- ↑ "Burden of the Beasts: Ranchers wonder why Their Livestock Suffer and Die," Houston Chronicle, http://www.chron.com/content/chronicle/nation/h2s/alberta.html Αρχειοθετήθηκε 2011-07-28 στο Wayback Machine.
- ↑ Σημείωση: Η στοιχειομετρική εξίσωση ισχύει για κάθε δισθενές μέταλλο ή μεταλλοειδές, ως M.
- ↑ Agency for Toxic Substances and Disease Registry (July 2006). "Toxicological Profile For Hydrogen Sulfide" (PDF). p. 154. Retrieved 2012-06-20.
- ↑ Holubnyak et al, SPE 141434-MS.
- ↑ "HYDROGEN SULFIDE" (PDF). Agency for Toxic Substances and Disease Registry.
- ↑ Jang, Yong-Chul; Townsend, Timothy (2001). «Sulfate leaching from recovered construction and demolition debris fines». Advances in Environmental Research 5 (3): 203–217. doi:.
- ↑ Cavinato, C (2013) [2013]. «Anaerobic digestion fundamentals» (PDF).
- ↑ Pokorna, Dana; Zabranska, Jana (November 2015). «Sulfur-oxidizing bacteria in environmental technology». Biotechnology Advances 33 (6): 1246–1259. doi:. PMID 25701621.
- ↑ Εκτίμηση 2005.
- ↑ Εκτίμηση 2005. Πηγή:The World Factbook.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.269, §11.6B8.
- ↑ 46,000,000 tons from 1600 plants worldwide in Der Claus-Prozess. Reich an Jahren und bedeutender denn je Bernhard Schreiner Chemie in unserer Zeit Volume 42 Issue 6, Pages 378 - 392 2009
- ↑ Η τιμή αυτή είναι ακριβής για συγκεντρώσεις 10 mmole-100 mmole/lit και θερμοκρασία 18 °C.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.266, §11.2Α2.
- ↑ Cartlidge, Edwin (18 Αυγούστου 2015). «Superconductivity record sparks wave of follow-up physics». Nature News. Ανακτήθηκε στις 18 Αυγούστου 2015.
- ↑ Francois Pouliquen· Claude Blanc· Emmanuel Arretz· Ives Labat· Jacques Tournier-Lasserve· Alain Ladousse· Jean Nougayrede· Gérard Savin· Raoul Ivaldi· Monique Nicolas· Jean Fialaire· René Millischer· Charles Azema· Lucien Espagno· Henri Hemmer· Jacques Perrot (200). «Hydrogen Sulfide». Ullmann's Encyclopedia of Chemical Industry. doi:10.1002/14356007.a13_467.
- ↑ Francois Pouliquen· Claude Blanc· Emmanuel Arretz· Ives Labat· Jacques Tournier-Lasserve· Alain Ladousse· Jean Nougayrede· Gérard Savin· Raoul Ivaldi· Monique Nicolas· Jean Fialaire· René Millischer· Charles Azema· Lucien Espagno· Henri Hemmer· Jacques Perrot (200). «Hydrogen Sulfide». Ullmann's Encyclopedia of Chemical Industry. doi:10.1002/14356007.a13_467.
- ↑ Stampler, Laura. «A Stinky Compound May Protect Against Cell Damage, Study Finds». Time. Time. Ανακτήθηκε στις 1 Δεκεμβρίου 2014.
- ↑ Khan, Natasha. «Rotten Egg Gas Seen Offering Promise of Extending Life». Bloomberg. Bloomberg. Ανακτήθηκε στις 1 Δεκεμβρίου 2014.
- ↑ http://www.marcabcoinc.com/page2.html
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||















![{\displaystyle \mathrm {H_{2}S+ROH{\xrightarrow[{\triangle }]{ThO_{2}}}RSH+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/80e9be67d455d42315895da09afbbeab4c40f608)


