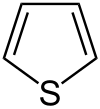
Θειοφαίνιο
- Να μην συγχέεται με το θειοφάνιο.
| Θειοφαίνιο | |||
|---|---|---|---|
| |||
| |||

| |||

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Θειοφαίνιο | ||
| Άλλες ονομασίες | Θειόλιο Θειοφουράνιο 1,4-επιθεια-1,3-βουταδιένιο 1,4-βουτα-1,3-διενυλενοσουλφίδιο Θεια(-2,4-)κυκλοπενταδιένιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C4H4S | ||
| Μοριακή μάζα | 84,14 amu | ||
| Σύντομος συντακτικός τύπος |
|||
| Αριθμός CAS | 110-02-1 | ||
| SMILES | c1ccsc1 | ||
| InChI | 1S/C4H4S/c1-2-4-5-3-1/h1-4H | ||
| Αριθμός RTECS | XM7350000 | ||
| Αριθμός UN | SMB37IQ40B | ||
| PubChem CID | 8030 | ||
| ChemSpider ID | 7739 | ||
| Ισομέρεια | |||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | −38°C | ||
| Σημείο βρασμού | 84°C | ||
| Πυκνότητα | 1.051 kg/m³ | ||
| Ιξώδες | 0,8712 cP (0,2 °C) 0,6432 cP (22,4 °C) | ||
| Δείκτης διάθλασης , nD |
1,5287 | ||
| Εμφάνιση | Άχρωμο υγρό | ||
| Χημικές ιδιότητες | |||
| Ελάχιστη θερμοκρασία ανάφλεξης |
-1°C | ||
| Επικινδυνότητα | |||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το θειοφαίνιο[1] (αγγλικά thiophene) είναι οργανική ετεροκυκλική αρωματική ένωση, που περιέχει άνθρακα, υδρογόνο και θείο, με χημικό τύπο C4H4S. Ανήκει στους θειαιθέρες. Ενώσεις ανάλογες με το θειοφαίνιο (δηλαδή ετεροκυκλικές αρωματικές ενώσεις με πενταμελή δακτύλιο και ένα (1) ετεροάτομο) είναι το φουράνιο και το πυρρόλιο. Εκτός από τη «μητρική» ένωση, ο όρος θειοφαίνιο μπορεί να αναφέρεται επίσης και σε μια ολόκληρη σειρά από «θυγατρικές» ή υποκατεστημένες παράγωγες ενώσεις, που περιέχουν έναν τουλάχιστον θειοφαινικό δακτύλιο. Δύο σημαντικές θυγατρικές ενώσεις του θειοφαίνιου είναι το βενζο[b]θειοφαίνιο και το διβενζοθειοφαίνιο.
Ιστορία[Επεξεργασία | επεξεργασία κώδικα]
Το θειοφαίνιο ανακαλύφθηκε ως μια πρόσμειξη σε βενζόλιο[2]. Παρατηρήθηκε ότι η ισατίνη σχηματίζει ένα μπλε βερνίκι, αν αναμειχθεί με θειικό οξύ και ακατέργαστο βενζόλιο. Ο σχηματισμός αυτής της μπλε ινδοφαινίνης για μακρύ χρονικό διάστημα πιστεύονταν (εσφαλμένα) ότι ήταν μια ιδιότητα του βενζολίου. Αλλά, ο Βίκτορ Μάγιερ (Victor Meyer) μπόρεσε να απομονώσει τη χημική ουσία που ήταν υπεύθυνη για τη συγκεκριμένη αντίδραση του ακατέργαστου βενζολίου. Αυτή η νέα (για τότε) ετεροκυκλική ένωση ήταν το θειοφαίνιο[3].
Φυσική παρουσία[Επεξεργασία | επεξεργασία κώδικα]
Το θειοφαίνιο και (αρκετά υποκατεστημένα) παράγωγά του βρίσκονται στο (αργό) πετρέλαιο, μερικές φορές σε συγκεντρώσεις μέχρι και 3%.Το θειοφαινικό περιεχόμενο στο (αργό) πετρέλαιο και σε γαιάνθρακα απομακρύνεται συνήθως από αυτά με τη διεργασία της υδροαποθείωσης (HydroDeSulfurization, HDS). Κατά τη διάρκεια αυτής της διεργασίας το υγρό ή αέριο (προς αποθείωση) υλικό διέρχεται πάνω από καταλύτη διθειούχου μολυβδαινίου (MoS2), μαζί με υδρογόνο υπό πίεση. Τα θειοφαίνια με τη διεργασία αυτή σχηματίζουν υδρογονάνθρακες και υδρόθειο (H2S). Έτσι, το ίδιο το «μητρικό» θειοφαίνιο μετατρέπεται σε βουτάνιο και υδρόθειο. Πιο επικρατούσα και προβληματική είναι η ύπαρξη στο (αργό) πετρέλαιο παραγώγων όπως το βενζοθειοφαίνιο και το διβενζοθειοφαίνιο.
Παραγωγή[Επεξεργασία | επεξεργασία κώδικα]
Κατ' αρχήν, το θειοφαίνιο είναι συστατικό της λιθανθρακόπισσας, από την οποία μπορεί να συναποσταχθεί μαζί με το βενζόλιο, γιατί έχουν παρόμοια θερμοκρασία βρασμού. Στην πράξη γίνεται κλασματική απόσταξη της λιθανθρακόπισσας και το θειοφαίνιο λαμβάνεται στο ίδιο κλάσμα με το βενζόλιο[4].
Αντανακλώντας την υψηλή σταθερότητά τους, τα θειοφαίνια μπορούν να προκύψουν με πολλές χημικές αντιδράσεις, που περιλαμβάνουν πηγές θείου και υδρογονάνθρακες, με πιο κατάλληλους τους ακόρεστους.
Το (μητρικό) θειοφαίνιο παράγεται παγκοσμίως σε κλίμακα της τάξης των 2.000 τόνων. Η (βιομηχανική) παραγωγή του περιλαμβάνει την αντίδραση στην αέρια φάση μιας πηγής θείου, τυπικά διθειάνθρακα (CS2) και 1-βουτανόλης. Αυτά τα αντιδραστήρια έρχονται σε επαφή με ένα οξείδιο, ως καταλύτη, στους 500–550 °C[5]:
Ο Βίκτορ Μάγιερ χρησιμοποίησε αιθίνιο και στοιχειακό θείο για την πρώτη παρασκευή θειοφαινίου, ένα χρόνο μετά την ανακάλυψή του:
Εναλλακτικά, χρησιμοποιήθηκε και η ισχυρή θέρμανση θείου με βουτάνιο, με 1-βουτένιο ή και με 1,3-βουταδιένιο[4][6]:
Επίσης, το θειοφαίνιο μπορεί να παραχθεί με θέρμανση φουρανίου, παρουσία υδροθείου και υδρατμών[4]:
Κλασσικά, (κυρίως τα θυγατρικά) θειοφαίνια παράγονται με αντιδράσεις 1,4-δικετόνων, διεστέρων ή δικαρβοξυλικών οξέων με θειωτικά αντιδραστήρια, όπως (για παράδειγμα) το δεκαθειούχο τετραφωσφόρο (P4S10).
Εξειδικευμένα θειοφαίνια μπορούν να συνθεθούν παρόμοια, χρησιμοποιώντας το αντιδραστήριο Λάβεσον (Lawesson's reagent) ή μέσω της αντίδρασης Γκιούβαλντ (Gewald reaction), που περιλαμβάνει τη συμπύκνωση δυο εστέρων παρουσία στοιχειακού θείου. Μια άλλη μέθοδος είναι η κυκλοποίηση Βόλχαρντ - Έρντμπαν (Volhard–Erdmann cyclization)

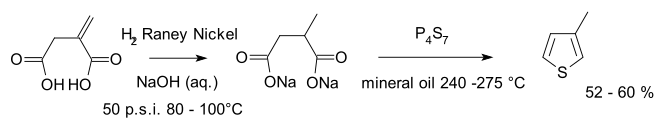
Μια ενδιαφέρουσα μέθοδος παραγωγής υποκατεστημένων θειοφαινίων χρησιμοποιεί 1,3-διίνια και υδρόθειο. Για παράδειγμα[4]:
Φυσικές ιδιότητες[Επεξεργασία | επεξεργασία κώδικα]
Στη θερμοκρασία δωματίου, το θειοφαίνιο είναι άχρωμο υγρό, με ήπια ευχάριστη οσμή, που θυμίζει αυτή του βενζολίου, με το οποίο το θειοφαίνιο μοιράζεται κάποιες ομοιότητες, όπως η μικρή διαφορά των σημείων βρασμού (4 °C, υπό κανονική πίεση) και το σχηματισμό αζεοτροπικού μίγματος με την αιθανόλη. Ο διαχωρισμός βενζολίου - θειοφαινίου είναι σχετικά δύσκολος και βασίζεται στη σουλφούρωση, έναντι της οπίας το θειοφαίνιο είναι πολύ πιο ευαίσθητο.
Δομή[Επεξεργασία | επεξεργασία κώδικα]
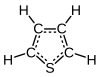
Το μόριο του θειοφαινίου είναι επίπεδο, με τις γωνίες CSC γύρω στους 93°, τις γωνίες CCS γύρω στους 109° και τις γωνίες CCC γύρω στους 114°. Οι δεσμοί C-S είναι περίπου 170 pm, οι δεσμοί C-C που είναι κοντά στο άτομο του θείου είναι περίπου 134 pm, και οι άλλοι 141 pm[7][8]
Χημική συμπεριφορά και παράγωγα[Επεξεργασία | επεξεργασία κώδικα]
Το θειοφαίνιο θεωρείται ότι είναι αρωματικό, παρόλο που σύμφωνα με θεωρητικούς υπολογισμούς ο βαθμός αρωματικότητάς του είναι μικρότερος σε σύγκριση με αυτόν του βενζολίου. Τα μονήρη ηλεκτρονιακά ζεύγη του ατόμου του θείου απεντοπίζονται σημαντικά στο π ηλεκτρονιακό σύστημα, που σχηματίζουν οι δυο (2) εναλλάξ διπλοί δεσμοί. Συνεπώς, εξαιτίας της αρωματικότητάς του, το θειοφαίνιο δεν παρουσιάζει ορισμένες από τις ιδιότητες που παρατηρούνται στους συμβατικούς θειαιθέρες. Για παράδειγμα, το άτομο του θείου του θειοφαινίου αντιστέκεται στην αλκυλίωση και στην οξείδωση. Ωστόσο, η οξείδωση του θειοφαινικού δακτυλίου θεωρείται ότι παίζει κρίσιμο ρόλο στη μεταβολική ενεργοποίηση διαφόρων θειοφαινικών παραγώγων, που χρησιμοποιούνται ως φάρμακα, όπως το τιενιλικό οξύ και το πειραματικό αντικαρκινικό φάρμακο OSI-930. Σε αυτές τις περιπτώσεις η οξείδωση μπορεί να γίνει τόσο στο θείο, δίνοντας οξυθειοφαίνιο, όπως και στον α- (2,3-) διπλό δεσμό, δίνοντας 2,3-εποξείδιο, ακολουθούμενο με σχηματισμό βάσεως shift με ΝΗ.
Πηγές[Επεξεργασία | επεξεργασία κώδικα]
- Παπαγεωργίου, Β.Π., Εφαρμοσμένη Οργανική Χημεία, Εκδόσεις Παρατηρητής, Θεσσαλονίκη 2005, ISBN 960-260-342-7
- SCHAUM'S OUTLINE SERIES, «ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ», Μτφ. Α. Βάρβογλη, 1999
- «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982
- Αναστάσιου Βάρβογλη, «Χημεία Οργανικών Ενώσεων», Παρατηρητής, Θεσσαλονίκη 1991
- Καραγκιοζίδη Σ. Πολυχρόνη, «Ονοματολογία Οργανικών Ενώσεων στα Ελληνικά & Αγγλικά» Β΄ Έκδοση Θεσσαλονίκη 1991
- Νικολάου Ε. Αλεξάνδρου, «Γενική Οργανική Χημεία», Εκδόσεις Ζήτη, Θεσσαλονίκη 1985
- Δημητρίου Ν. Νικολαΐδη, «Ειδικά Μαθήματα Οργανικής Χημείας», ΑΠΘ, θεσσαλονίκη 1983
- Νικολάου Ε. Αλεξάνδρου, Αναστάσιου Βάρβογλη, Φαίδωνα Χατζημηχαλάκη, «Εργαστηριακός Οδηγός», Εκδόσεις Ζήτη, Θεσσαλονίκη 1986
- Νικολάου Ε. Αλεξάνδρου, Αναστάσιου Βάρβογλη, Δημητρίου Ν. Νικολαΐδη: «Χημεία Ετεροκυκλικών Ενώσεων», Εκδόσεις Ζήτη, Θεσσαλονίκη 1985
- Διαδικτυακοί τόποι που αναφέρονται στις «Αναφορές και παρατηρήσεις».
Παραπομπές και παρατηρήσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Δείτε τις εναλλακτικές ονομασίες στον παρακείμενο πίνακα πληροφοριών χημικής ένωσης.
- ↑ Viktor Meyer (1883). "Ueber den Begleiter des Benzols im Steinkohlenteer" [On a substance that accompanies benzene in coal tar]. Berichte der Deutschen chemischen Gesellschaft 16: 1465–1478. doi:10.1002/cber.188301601324.
- ↑ Ward C. Sumpter (1944). "The Chemistry of Isatin". Chemical Reviews 34 (3): 393–434. doi:10.1021/cr60109a003.
- ↑ 4,0 4,1 4,2 4,3 Νικολάου Ε. Αλεξάνδρου, Αναστάσιου Βάρβογλη, Δημητρίου Ν. Νικολαΐδη: «Χημεία Ετεροκυκλικών Ενώσεων», Εκδόσεις Ζήτη, Θεσσαλονίκη 1985, §4.2., σελ. 53.
- ↑ Jonathan Swanston "Thiophene" in Ullmann’s Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2006. doi:10.1002/14356007.a26_793.pub2
- ↑ Beyer-Walter, Lehrbuch der Organischen Chemie, 23. Auflage, S. Hirzel Verlag 1998.
- ↑ Figures from the Cambridge Structural Database.
- ↑ Σημείωση; Σύμφωνα με Νικολάου Ε. Αλεξάνδρου, Αναστάσιου Βάρβογλη, Δημητρίου Ν. Νικολαΐδη: «Χημεία Ετεροκυκλικών Ενώσεων», Εκδόσεις Ζήτη, Θεσσαλονίκη 1985, §4.2., σελ. 52, οι παραπάνω αναφερόμενες τιμές, είναι λίγο διαφορετικές: CSC: 92°, SCC: 111°, CCC: 112°, C-S: 170 pm, C-C [b]: 137 pm και C-C [c]: 140 pm.
| ||||||||||||||








![{\displaystyle \mathrm {HC\equiv CC\equiv CH+H_{2}S{\xrightarrow[{\triangle }]{^{-}OH}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/fb0597b101138f1e226a22c67418894eb392bec1)