Θειαιθέρες
Οι θειαιθέρες ή (οργανικά) σουλφίδια είναι μια ομάδα οργανικών ενώσεων του θείου που περιέχουν ως κύρια χαρακτηριστική ομάδα μια τουλάχιστον ομάδα του τύπου C-S-C ή RS- (αλκυλοθειομάδα, όπου R: με την ευρεία έννοια οποιασδήποτε ανθρακούχας ομάδας).
Όπως πολλές άλλες θειούχες ενώσεις, οι θειαιθέρες έχουν έντονη οσμή. Είναι ακριβώς οι θειούχες αντίστοιχες ενώσεις των αιθέρων. Επειδή το θείο και το οξυγόνο ανήκουν στην ίδια ομάδα του περιοδικού συστήματος, υπάρχουν αρκετές ομοιότητες στη συμπεριφορά των δυο ομάδων ενώσεων. Υπάρχουν όμως και διαφορές που πηγάζουν από τη σημαντική διαφορά ηλεκτραρνητικότητας των δυο στοιχείων και του γεγονότος ότι το θείο διαθέτει επιπλέον από το οξυγόνο τα 3d (έστω και κενά) τροχιακά. Τα δυο αυτά στοιχεία δείνουν στο θείο και στις δισθενείς ενώσεις του τη δυνατότητα οξείδωσης ή και συναρμογής με υψηλότερα σθένη, έως και έξι (6).
- Στους θειαιθέρες κατατάσσονται από ορισμένους συγγραφείς και τα (οργανικά) δισουλφίδια (και γενικότερα (οργανικά) πολυσουλφίδια, δηλαδή ενώσεων που περιέχουν ως κύρια τη χαρακτηριστική ομάδα -C-S-S-C- (-C-(S)n-C-). Το θείο σχηματίζει πολύ σταθερότερες τέτοιες γέφυρες από ότι το οξυγόνο.
Ταξινόμηση[Επεξεργασία | επεξεργασία κώδικα]
Οι θειαιθέρες γενικά ταξινομούνται όπως οι αιθέρες. Μερικές από τις ταξινομήσεις τους είναι οι ακόλουθες:
1. Ως προς τον αριθμό των ομάδων C-S-C που διαθέτουν:
- Μονοθειαιθέρες: Διαθέτουν μία (1) ομάδα C-S-C. Π.χ. διμεθυλοθειαιθέρας (CH3SCH3).
- Διθειαιθέρες: Διαθέτουν δύο (2) ομάδες C-S-C. Π.χ. 1,2-διμεθυλοθειοαιθάνιο (CH3SCH2CH2SCH3).
- Πολυθειαιθέρες: Διαθέτουν περισσότερες από δύο (2) ομάδες C-S-C. Π.χ. 1,2,3-τριμεθυλοθειοπροπάνιο (CH3SCH2CH(SCH3)CH2SCH3).
2. Ως προς την παρουσία κατώτερων χαρακτηριστικών ομάδων:
- Αλκινυλθειαιθέρες: Η μία τουλάχιστον από τις ανθρακούχες ομάδες περιέχει τριπλό δεσμό. Π.χ. αιθινυλομεθυλθειαιθέρας (HC ≡ CSCH3).
- Αλκενυλθειαιθέρες: Η μία τουλάχιστον από τις ανθρακούχες ομάδες περιέχει διπλό δεσμό. Π.σ. βινυλομεθυλθειαιθέρας (CH2=CHSCH3).
- Αρυλθειαιθέρες: Η μία τουλάχιστον από τις ανθρακούχες ομάδες περιέχει ομάδα βενζολικού δακτυλίου ή συστήματος συμπυκνωμένων βενζολικών δακτυλίων (π.χ. ναφθυλομάδα). Π.χ. θειανισόλη (PhSCH3)
- Αλοαλκυλθειαιθέρες: Η μία τουλάχιστον από τις ανθρακούχες ομάδες περιέχει αλογόνο. Π.χ. μεθυλο(2-χλωροαιθυλο)θειαιθέρας (ClCH2CH2SCH2).
- νιτροαλκυλθειαιθέρες: Η μία τουλάχιστον από τις ανθρακούχες ομάδες περιέχει νιτροομάδα. Π.χ. μεθυλο(2-νιτροαιθυλο)θειαιθέρας (Ο2ΝCH2CH2SCH2).
- νιτρωδοοαλκυλθειαιθέρες: Η μία τουλάχιστον από τις ανθρακούχες ομάδες περιέχει νιτρωδοομάδα. Π.χ. μεθυλο(2-νιτρωδοαιθυλο)θειαιθέρας (ΟΝCH2CH2SCH2).
- διαζωαλκυλθειαιθέρες: Η μία τουλάχιστον από τις ανθρακούχες ομάδες περιέχει διαζωομάδα. Π.χ. μεθυλο(2-διαζωαιθυλο)θειαιθέρας (Ν2=CHCH2SCH2).
- αζωαλκυλθειαιθέρες: Η μία τουλάχιστον από τις ανθρακούχες ομάδες περιέχει αζωομάδα. Π.χ. μεθυλο(2-(μεθυλαζω)αιθυλο)θειαιθέρας (CH3Ν=NCH2CH2SCH2).
- διαλκυλθειαιθέρες: Όλες οι ανθρακούχες ομάδες είναι αλκύλια. Π.χ. διμεθυλοθειαιθέρας (CH3SCH3).
3. Ως προς το είδος των δακτυλίων που περιέχονται:
- Αλειφστικοί θειαιθέρες: Η ένωση δεν περιέχει κανένα δακτύλιο. Π.χ. διμεθυλοθειαιθέρας (CH3SCH3).
- Ισοκυκλικοί θειαιθέρες: Η ένωση περιέχει έναν τουλάχιστον δακτύλιο χωρίς ετεροάρτομα ή αρωματικό χαρακρτήρα. Π.χ. κυκλοεξυλομεθυλθειαιθέέρας (
 )
) - Αρωματικοί θειαιθέρες: Η ένωση περιέχει έναν τουλάχιστον δακτύλιο με αρωματικό χαρακτήρα. Π.χ. θειανισόλη (PhSCH3)
- Ετεροκυκλικοί θειαιθέρες: Η ένωση περιέχει έναν τουλάχιστον δακτύλιο με ετεροάτομα, συνήθως η ίδια η ομάδα C-S-C συμμετέχει στον ετεροκυκλικό δακτύλιο. Π.χ θειιράνιο (
 )
)
4. Τέλος, με βάση την ύπαρξη γέφυρας περισσότερων του ενός ατόμων θείου έχουμε:
- (Απλοί) θειαιθέρες ή σουλφίδια: Δεν περιέχουν καμιά γέφυρα περισσότερων του ενός ατόμων θείου.
- (Διθει)θειαιθέρες ή δισουλφίδια: Περιέχουν μία τουλάχιστον γέφυρα δύο ατόμων θείου.
- (Πολυθει)θειαιθέρες ή πολυσουλφίδια: Περιέχουν μία τουλάχιστον γέφυρα περισσότερων από δύο ατόμων θείου.
Ονοματολογία[Επεξεργασία | επεξεργασία κώδικα]
Η κατά IUPAC ονοματολογία των θειαιθέρων γίνεται όπως στους αιθέρες με την προσθήκη του προθέματος «θει-» στην κατάληξη «αιθέρας» (π.χ. διμεθυλοθειαιθέρας αντί διμεθυλαιθέρας ή με την αντικατάσταση του προθέματος «οξυ-» με το «θειο-», όταν η ομάδα δηλώνεται σαν υποκαταστάτης (π.χ. «μεθυλοθειο-», για την ομάδα CH3S-, αντί του «μεθοξυ-» της αντίστοιχης CH3S, των αιθέρων). Συνήθως το ίδιο σύστημα διατηρείται και στις ενώσεις που οι αντίστοιχες οξυγονούχες διατηρούν επισήμως εμπειρικά ονόματα. Π.χ. το «ανισόλη» (PhOMe) γίνεται «θειανισόλη» (PhSMe), για να δηλωθεί η αντίστοιχη θειούχα ένωση. Γνωστή εξαίρεση αποτελεί η ένωση θαιοφαίνιο που είναι η αντίστοιχη θειούχα ένωση του φουράνιου.
- Επίσης είναι σε χρήση και η κατάληξη «-σουλφίδιο» αντί της κατάληξης «-θειαιθέρας».
- Σε μέρος της ελληνικής βιβλιογραφίας θεωρείται ότι η ομάδα μπαίνει πάντα ως υποκαταστάτης[1].
- Σε περίπτωση που υπάρχουν περισσότερες από μια ομάδες C-S-C στην ένωση, αυτές δηλώνονται με προθέματα του τύπου «δι»-, «τρι-» κ.τ.λ. μπροστά από το «θει-» (π.χ. διμεθυλοαιθυλενοδιθειαιθέρας-1,2) (CH3SCH2CH2SCH3) ή κάποιες από αυτές δηλώνονται ως υποκαταστάτες. Π.χ. η προηγούμενη ένωση μπορεί να δηλωθεί και ως 2-(μεθυλοθειο)αιθυλοθειαιθέρας[2]. Επειδή όμως μέρος της βιβλιογραφίας εντάσει τα (Οργανικά) πολυσουλφίδια στους θειαιθέρες είναι δυνατό να προκύψει σύγχυση με τα προθέματα δι- (τρι-...) για το αν πρόκειται για δυο (τρεις...) ομάδες C-S-C ή μία ομάδα C-S-S-C (C-S-S-S-C...)., οπότε δεν είναι περιττές οι διευκρινίσεις. Π.χ. Αν έχουμε την ένωση CH3SSCH3, αυτή μπορεί να ονομαστεί διμεθυλο(διθειο)αιθέρας ή πιο σωστά, αφού η βιβλιογραφία ταύτισης χρησιμοποιεί στην ονονατολογία την κατάληξη -σουλφίδιο, διμεθυλοδισουλφίδιο. Διευκρινίζεται ότι στα μεν δισουλφίδια οι ανθρακούχες ομάδες είναι δύο, ενώ στους διθειαιθέρες είναι τρεις.
- Σε πολύπλοκες περιπτώσεις χρησιμοποιείται η μέθοδος της ονοματολογίας με αντικατάσταση, δηλαδή η ένωση ονομάζεται σαν υδρογονάνθρακας, μετρώντας και τα τυχόν άτομα άλλων στοιχείων (ετεροάτομα) ως άτομα άνθρακα, και προτάσσοντας έπειτα ως υποκαταστάσεις τα ετεροάτομα με τους αριθμούς θέσης τους. Π.χ. η ένωση CH3SCH2CH2SCH2CH(CH3)CH2SSCH3 ονομάζεται (για απλούστευση) 2,3,7,10-τετραθει-5-μεθυλοεντεκάνιο.
| Αιθέρες και Θειαιθέρες - Παραδείγματα ονοματολογίας | |||
| Τύπος αιθέρα | Ονομασία αιθέρα | Τύπος θειαιθέρα | Ονομασία θειαιθέρα |
|---|---|---|---|
| MeOMe | διμεθυλαιθέρας | MeSMe | διμεθυλοθειαιθέρας |
| EtOMe | μεθυλαιθυλαιθέρας | EtSMe | μεθυλθειαιθυλαιθέρας |
| ViOMe | μεθυλoβινυλαιθέρας | ViSMe | μεθυλoβινυλθειαιθέρας |
| PhOMe | ανισόλη | PhSMe | θειανισόλη |
| PhOPh | διφαινυλαιθέρας | PhSPh | διφαινυλθειαιθέρας |
| MeOCH2OMe | διμεθυλομεθυλενοδιαιθέρας ή δι(μεθοξυ)μεθάνιο |
MeOCH2SMe | διμεθυλομεθυλενοδι(θειαιθέρας) ή δι(μεθυλοθειο)μεθάνιο |
 |
κυκλοεξυλομεθυλαιθέρας | 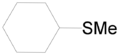 |
κυκλοεξυλομεθυλθειαιθέρας |
 |
ανηθάλη |  |
θειανηθάλη |
 |
οξιράνιο |  |
θειιράνιο |
| μεθυλοοξιράνιο | μεθυλοθειιράνιο | ||
 |
1,4-διοξάνιο |  |
1,4-διθειάνιο |
Δομή[Επεξεργασία | επεξεργασία κώδικα]
Τα άτομα της χαρακτηριστικής ομάδας των θειαιθέρων (C-S-C) τοποθετούνται σε γωνία ακριβώς 90° (αντί των ~120° της ομάδας C-O-C των αιθέρων). Οι δε δεσμοί C-S έχουν μήκος περίπου 180 pm (αντί των περίπου 150 pm των δεσμών C-Ο των αιθέρων) και πόλωση ~1,5‰ (αντί ~19% των δεσμών C-Ο των αιθέρων). Αυτές οι διαφορές, μαζί με τη μεγαλύτερη πλωσιμότητα του θείου από το οξυγόνο δικαιολογούν τις διαφορές στις φυσικές και χημικές ιδιότητες των αντίστοιχων ενώσεων θειαιθέρων και αιθέρων. Σε γενικές τάσεις οι θειαιθέρες είναι λιγότερο πτητικοί, με υψηλότερο σημείο τήξης και λιγότερο υδρόφιλοι από τους αντίστοιχους αιθέρες.
Παραγωγή[Επεξεργασία | επεξεργασία κώδικα]
Με διαλκυλίωση θειούχων αλάτων[Επεξεργασία | επεξεργασία κώδικα]
Με διαλκυλίωση από αλκυλαλογονίδια (όπου αλκυλο- (R), με την ευρεία έννοια κάθε ανθρακούχας ομάδας) θειούχων αλάτων παράγονται θειαιθέρες με δυο όμοιες ανθρακούχων ομάδων[3]:
Με αλκυλίωση αλάτων θειολών[Επεξεργασία | επεξεργασία κώδικα]
Με αλκυλίωση από αλκυλαλογονίδια (όπου αλκυλο- (R), με την ευρεία έννοια κάθε ανθρακούχας ομάδας) αλάτων θειολών (π.χ. R'SK) παράγονται θειαιθέρες και με δυο ανόμοιες ανθρακούχων ομάδων[3]. (Αντίδραση Williamson για θειαιθέρες):
Αναγωγή σουλφοξειδίων[Επεξεργασία | επεξεργασία κώδικα]
Με αναγωγή σουλφοξειδίων από υδροϊώδιο παράγονται θειαιθέρες και με δυο ανόμοιες ανθρακούχων ομάδων[4]:
Οργανικά δισουλφοξείδια[Επεξεργασία | επεξεργασία κώδικα]
1. Με επίδραση χλωριούχου χαλκού σε θειόλες παράγονται δισουλφίδια με δυο όμοιες ανθρακούχων ομάδων[5]:
2. Με επίδραση αλκυλαλογονιδίων (RX) σε (Ανόργανα (δισουλφίδια), όπως το Na2S2, παράγονται δισουλφίδια με δυο όμοιες ανθρακούχων ομάδων[6]:
3. Με επίδραση αλάτων θειολών (RSNa) σε σουλφενυλοαλογονίδια (R'SX), παράγονται δισουλφίδια και με δυο ανόμοιες ανθρακούχων ομάδων.[7]:
Παράγωγα θειαιθέρων[Επεξεργασία | επεξεργασία κώδικα]
Επίδραση διαλογονούχου υδραργύρου[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση διαλογονούχου υδραργύρου (HgX2) παράγονται διαλκυλοθειουδραργιρικά άλατα[8]:
Επίδραση αλκυλαογονιδίων[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση αλκυλαογονιδίων (RX) παράγονται άλατα του σουλφωνίου[9]:
Οξείδωση προς σουλφοξείδια[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση υπεροξείδιου του υδρογόνου οξειδώνονται προς σουλοφοξείδια[10]:
Παράγωγα δισουλφιδίων[Επεξεργασία | επεξεργασία κώδικα]
Επίδραση αλογόνου[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση αλογόνου παράγονται σουλφενυλοαλογονίδια[7]:
Αναγωγή[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση «υδρογόνου εν τω γεννάσθαι» (δηλαδή μέταλλο + οξύ) παρράγονται θειόλες[11]:
Φυσική παρουσία και εφαρμογές[Επεξεργασία | επεξεργασία κώδικα]
Οι θειαιθέρες είναι σημαντικοί στη Βιολογία. Παραδείγματα αποτελούν το αμινοξύ μεθειονίνη, που διαθέτει μεθυλοθειοομάδα και άρα ιδιότητες θειαιθέρα, και του συνένζυμου βιοτίνη. Το πετρέλαιο περιέχει μεγάλει πολλές οργανικές ενώσεις του θείου, στις οποίες περιλαμβάνονται θειαιθέρες. Μερικοί από αυτούς περιέχουν διπλούς δεσμούς και άρα είναι πολυμερίσιμοι, αχηματίζοντας χρήσιμα πλαστικά προϊόντα. Ακόμη, το συνένζυμο Μ. CH3SCH2CH2SO3- είναι πρώτη ύλη για την παραγωγή μεθανίου (π.χ. για φυσικό αέριο μέσω της διεργασίας της μεθανογένεσης.
Αναφορές και παρατηρήσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Πολυχρόνη Σ. Καραγκιοζίδη: Ονοματολογία οργανικών ενώσεων, Θεσσαλονίκη 1991, Έκδοση Β΄: Σελ.53. Πίναας B1.3.
- ↑ Η εισαγωγή του άρθρου, η ταξινόμηση και η ονοματολογία βασίστηκε στην ακόλοθη πηγή: Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 5-9, 13-14.
- ↑ 3,0 3,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ,266, §Β1.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, Σελ.360,§20.6.Π4→3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ,266, §Γ.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, Σελ.360,§20.6.Π2β.
- ↑ 7,0 7,1 SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, Σελ.360,§20.6.I2.1.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, Σελ.360,§20.6.I3α.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, Σελ.360,§20.6.I3β.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, Σελ.360,§20.6.I3→4.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, Σελ.360,§20.6.I2.2.
Πηγές[Επεξεργασία | επεξεργασία κώδικα]
- Ν. Αλεξάνδρου, Γενική Οργανική Χημεία, ΘΕΣΣΑΛΟΝΙΚΗ 1985
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Πολυχρόνη Σ. Καραγκιοζίδη: Ονοματολογία οργανικών ενώσεων, Θεσσαλονίκη 1991, Έκδοση Β΄.
- Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροκυκλικών Ενώσεων, Θεσσαλονίκη 1985, Έκδοση Β΄.
- Δ. Νικολαΐδη: Ειδικά κεφάλαια Οργανικής Χημεία, Θεσσαλονίκη 1983.
| |||||||||||||||||||||||







![{\displaystyle \mathrm {RSR{\acute {}}+HgX_{2}{\xrightarrow {}}[R(R{\acute {}})SHg]X_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/f1b110292f42dea4dd4a8974c483338bca00950e)
![{\displaystyle \mathrm {RSR_{1}+R_{2}X{\xrightarrow {}}[R(R_{1})(R_{2})S]X} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/102de531ab1a03e006da7ed06a3b75ab642b50d3)


